
| A. | NH3 | B. | CF4 | C. | H2S | D. | CO32- |
分析 根据价层电子对互斥理论确定其空间构型,价层电子对数=σ 键个数+$\frac{1}{2}$(a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数,据此分析解答.
解答 解:A.NH3分子中,N的价层电子对个数=3+$\frac{1}{2}$(5-1×3)=4,所以N原子采取sp3杂化,含有一个孤电子对,故空间结构为三角锥形,故A错误;
B.CF4中C的价层电子对个数=4+$\frac{1}{2}$(4-1-4×1)=4,所以CF4中C原子采取sp3杂化,故空间结构为正四面体,故B错误;
C.H2S分子中,中心S原子价层电子对个数=2+$\frac{1}{2}$×(6-2×1)=4,含有2个孤电子对,采取sp3杂化,空间结构为V形,故C错误;
D.CO32-中价层电子对个数=3+$\frac{1}{2}$(4+2-3×2)=3,所以CO32-中C原子采取sp2杂化,空间结构为平面正三角形,故D正确;
故选D.
点评 本题考查了粒子空间构型的判断,根据价层电子对互斥理论来分析解答即可,该知识点为考试热点,要熟练掌握方法、技巧,难点是孤电子对个数的计算方法,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2是淡黄色固体,久置于空气中变成Na2O | |
| B. | Na2O2与水的反应中,Na2O2只作氧化剂 | |
| C. | 用0.1mol Na2O2与足量水反应转移的电子的物质的量为0.2mol | |
| D. | Na2O2放入饱和NaOH溶液中,放出大量的O2,并有白色固体析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开发生物质能替代化石燃料 | B. | 向高空排放金属冶炼产生的粉尘 | ||
| C. | 用催化转化技术处理汽车尾气 | D. | 大力推广生产和使用无氟冰箱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 500 | 4600 | 6900 | 9500 |
| B | 740 | 1500 | 7700 | 10500 |
| C | 580 | 1800 | 2700 | 11600 |
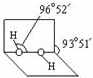 分子中氧原子采取sp3杂化;通常情况下,H2O2与水任意比互溶的主要原因是H2O2分子与水分子间形成氢键,使H2O2与水任意比互溶.
分子中氧原子采取sp3杂化;通常情况下,H2O2与水任意比互溶的主要原因是H2O2分子与水分子间形成氢键,使H2O2与水任意比互溶.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:丁>丙>乙 | |
| B. | 81号元素铊与丙元素处同主族,则铊的最高价氧化物对应水化物呈两性 | |
| C. | 电解法可以用乙与丙形成的化合物制得丙单质 | |
| D. | 同周期元素中丁的最高价氧化物对应水化物的酸性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com