
科目:高中化学 来源: 题型:阅读理解
| 结构简式 | HOOH-COOH | |||
| 溶解性 | 能溶于水,易溶于乙醇 | |||
| 特性 | 大约在157℃升华(175℃以上发生分解) | |||
| 化学性质 | H2C2O4+Ca(OH)2═CaC2O4↓+2H2O | |||
HOOC-COOH
| ||||
| 2KMnO4+5H2C2O4+3H2SO4═KSO4+2MnSO4+10CO2↑2O |
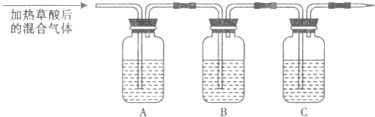
| 仪器 | A | B | C |
| 加入试剂 | NaOH溶液 |
| 滴定前均为 | 第一次终点 | 第二次终点 | 第三次终点 | |
| 滴定管液面刻度 | 0.00mL | 20.02mL | 21.00mL | 19.98mL |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:
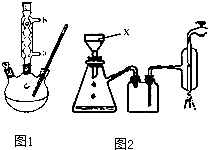 【实验化学】
【实验化学】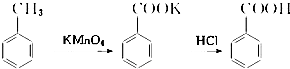
| T/℃ | 4 | 18 | 75 |
| 溶解度/g | 0.18 | 0.27 | 2.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室常用高锰酸钾与浓盐酸反应制取氯气:KMnO4+HCl——KCl+MnCl2+Cl2↑+H2O,其中还原剂是_________。若消耗0.1 mol氧化剂,则被氧化的还原剂的物质的量是_________mol。若需2.24 L(标准状况)氯气,反应中消耗盐酸的物质的量为_________mol,转移的电子数是_________mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com