
 ,其原子核外共有22种运动状态不相同的电子.金属钛晶胞如图1所示,为六方最密堆积(填堆积方式).
,其原子核外共有22种运动状态不相同的电子.金属钛晶胞如图1所示,为六方最密堆积(填堆积方式).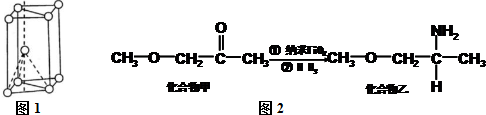

分析 (1)Ti原子价电子为3d、4s电子,3d能级上有2个电子、4s能级上有2个电子;原子核外有几个电子其电子就有几种运动状态;该晶体为六方最密堆积;
(2)分子晶体熔沸点较低;
(3)氢键的存在导致物质熔沸点升高;同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素;
(4)每个O原子被两个Ti原子共用、每个Ti原子被两个O原子共用,利用均摊法计算二者原子个数之比;
Ti元素为+4价、O元素为-2价,据此书写其化学式;
(5)钛离子位于立方晶胞的角顶,被6个氧离子包围成配位八面体;钙离子位于立方晶胞的体心,被12个氧离子包围;每个晶胞中钛离子和钙离子均为1个,晶胞的12个边长上各有一个氧原子,根据均摊原则计算各原子个数,从而确定化学式.
解答 解:(1)Ti原子价电子为3d、4s电子,3d能级上有2个电子、4s能级上有2个电子,其价电子排布图为 ;原子核外有几个电子其电子就有几种运动状态,Ti原子核外有22个电子,所以其原子核外电子有22种运动状态;该晶体为六方最密堆积,
;原子核外有几个电子其电子就有几种运动状态,Ti原子核外有22个电子,所以其原子核外电子有22种运动状态;该晶体为六方最密堆积,
故答案为: ;22;六方最密;
;22;六方最密;
(2)分子晶体熔沸点较低,该物质熔沸点较低,属于分子晶体,故答案为:分子;
(3)氢键的存在导致物质熔沸点升高,乙中含有氢键、甲不含氢键,所以化合物乙熔沸点高于甲;能形成sp3杂化的原子有C、N、O元素,同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,所以第一电离能N>O>C,
故答案为:化合物乙分子间形成氢键;N>O>C;
(4)每个O原子被两个Ti原子共用、每个Ti原子被两个O原子共用,利用均摊法计算二者原子个数之比为1:1;
Ti元素为+4价、O元素为-2价,据此书写其化学式为,
故答案为:1:1;TiO2+(或[TiO]n2n+);
(5)钛离子位于立方晶胞的角顶,被6个氧离子包围成配位八面体;钙离子位于立方晶胞的体心,被12个氧离子包围;每个晶胞中钛离子和钙离子均为1个,晶胞的12个边长上各有一个氧原子,根据均摊原则,每个晶胞实际占有氧原子数目为12×$\frac{1}{4}$=3,则晶胞的化学式为CaTiO3,
故答案为:6;12;CaTiO3.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、元素周期律、晶体类型判断、原子核外电子排布式的书写等知识点,侧重考查学生分析判断及计算、空间想象能力等,明确基本原理及基本性质即可解答,难点是晶胞计算.


科目:高中化学 来源: 题型:选择题
| A. | c(OH-)=0.1mol/L的溶液:Na+、K+、CO32-、ClO- | |
| B. | 滴入酚酞显红色的溶液中:Na+、Al3+、CO32-、AlO2- | |
| C. | 含有Fe3+的溶液中:Na+、Al3+、Cl-、SCN- | |
| D. | pH=1的溶液中:Fe2+、Cl-、NO3-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、OH-、S2O${\;}_{3}^{2-}$、Cl- | B. | Fe2+、K+、H+、NO${\;}_{3}^{-}$ | ||
| C. | H+、C2O${\;}_{4}^{2-}$、MnO${\;}_{4}^{-}$、SO${\;}_{4}^{2-}$ | D. | Na+、Ca2+、AlO${\;}_{2}^{-}$、HCO${\;}_{3}^{-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知:
已知: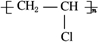 ,FCH2OHCH2OH.
,FCH2OHCH2OH.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | SO2+Br2+2H2OH2SO4+2HBr与2HBr+H2SO4(浓) Br2+SO2↑+2H2O互为可逆反应 | |
| B. | 既能向正反应方向进行,又能向逆反应方向进行的反应叫可逆反应 | |
| C. | 在同一条件下,同时向正、逆两个方向进行的反应叫可逆反应 | |
| D. | 在一定条件下,SO2被氧化成SO3的反应是可逆反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
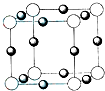 X、Y、Z、W、U五种元素,均位于周期表的前四周期,它们的核电荷数依次增加,且核电荷数之和为57.Y原子的L层p轨道中有2个电子,Z的原子核外有三个未成对电子,W与Y原子的价电子数相同,U原子的K层电子数与最外层电子数之比为2:1,其d轨道处于全充满状态.
X、Y、Z、W、U五种元素,均位于周期表的前四周期,它们的核电荷数依次增加,且核电荷数之和为57.Y原子的L层p轨道中有2个电子,Z的原子核外有三个未成对电子,W与Y原子的价电子数相同,U原子的K层电子数与最外层电子数之比为2:1,其d轨道处于全充满状态.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com