
| A. | c=$\frac{m}{VM}$ | B. | m=ρVM | C. | W%=$\frac{cM}{1000p}$% | D. | c=$\frac{1000ρW%}{M}$ |
分析 A、物质的量浓度C=$\frac{n}{V}$;
B、m=nM;
C、W%=$\frac{溶质的质量}{溶液的质量}×100%$;
D、物质的量浓度C=$\frac{n}{V}$.
解答 解:A、物质的量浓度C=$\frac{n}{V}$=$\frac{\frac{mg}{Mg/mol}}{VmL×1{0}^{-3}}$=$\frac{1000m}{VM}$mol/L,故A错误;
B、m=nM=cmol/L×VmL×10-3×Mg/mol=$\frac{cVM}{1000}$g,故B错误;
C、W%=$\frac{溶质的质量}{溶液的质量}×100%$=$\frac{cmol/L×VmL×1{0}^{-3}×Mg/mol}{ρg/mL×VmL}×100%$=$\frac{cM}{10ρ}%$,故C错误;
D、物质的量浓度C=$\frac{n}{V}$=$\frac{\frac{ρg/mL×VmL×W%}{M}}{VmL×1{0}^{-3}}$=$\frac{1000ρW%}{M}$,故D正确.
故选D.
点评 本题考查物质的量浓度、质量分数计算,属于字母型计算,增大计算难度,注意理解掌握物质的量浓度与质量分数之间关系,难度中等.


科目:高中化学 来源: 题型:实验题

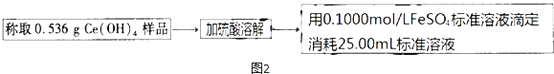
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2$\stackrel{HCl(aq)}{→}$SiCl4$→_{还原}^{H_{2}}$Si | |
| B. | N2$→_{高温、高压、催化剂}^{H_{2}}$NH3$\stackrel{HCl(aq)}{→}$NH4Cl(aq) | |
| C. | FeS2$→_{还原}^{O_{2}}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| D. | MgCO3$\stackrel{HCl(aq)}{→}$MgCl2(aq)$\stackrel{电解}{→}$Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
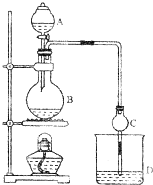 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、乙酸,D中放有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、乙酸,D中放有饱和碳酸钠溶液.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C8H18(1)+$\frac{25}{2}$O2(g)=8CO2(g)+9H2O(g);△H=-48.40kJ/mol | |
| B. | C8H18(1)+$\frac{25}{2}$O2(g)=8CO2(g)+9H2O(1);△H=-5518kJ/mol | |
| C. | C8H18(1)+$\frac{25}{2}$O2(g)=8CO2(g)+9H2O(l);△;△H=+5518kJ/mol | |
| D. | 2C8H18(1)+25O2(g)=16CO2(g)+18H2O(1);△H=-11036kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Tl+的最外层有1个电子 | B. | Tl3+的氧化性比Al3+强 | ||
| C. | Tl 能形成+3价和+1价的化合物 | D. | Tl+的还原性比Ag强 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件未标出),其中反应①是置换反应,A是常见的金属单质,D是无色气体单质、F是黄绿色气态单质,反应①②均在水溶液中进行的.
A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件未标出),其中反应①是置换反应,A是常见的金属单质,D是无色气体单质、F是黄绿色气态单质,反应①②均在水溶液中进行的. ,
,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大理石 CaCO3 酸 | B. | 纯碱 Na2CO3 碱 | ||
| C. | 熟石灰 Ca(OH)2 碱 | D. | 烧碱 NaOH 盐 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com