
| 变化 | △H | △S | 方向性 | |
| A | H2O(l)→H2O(g) | >0 | <0 | 非自发 |
| B | 2NO2(g)?N2O4(g) | <0 | <0 | 自发 |
| C | 2Fe3+(aq)+Cu(s)=2Fe2+(aq)+Cu2+(aq) | >0 | >0 | 自发 |
| D | NH4Cl(s)=NH3(g)+HCl(g) | <0 | >0 | 非自发 |
| A. | A | B. | B | C. | C | D. | D |
分析 反应的熵变可以依据反应前后气体体积变化分析判断,反应是否自发进行的判断依据是依据△H-T△S分析判断,当△H-T△S<0反应自发进行,△H-T△S>0,反应非自发进行.
解答 解:A.H2O(l)→H2O(g),△H>0,△S>0,则△H-T△S>0,高温下反应可能自发进行,故A错误;
B.2NO2(g)?N2O4(g),△H<0,△S<0,则△H-T△S>0,低温下反应自发进行,故B正确;
C.2Fe3+(aq)+Cu(s)=2Fe2+(aq)+Cu2+(aq),△H<0,△S>0,则△H-T△S<0,反应一定自发进行,故C错误;
D.NH4Cl(s)=NH3(g)+HCl(g),△H>0,△S>0,高温下△H-T△S<0,反应自发进行,故D错误;
故选B.
点评 本题考查了反应自发进行的判断依据,主要是反应的焓变和熵变的分析判断,掌握基础是解题关键,题目较简单.


科目:高中化学 来源: 题型:解答题
| 实验序号 | 操作现象 |
| i | 取少量固体样品,加入过量稀盐酸,固体溶解,产生气体(经检验为H2),溶液呈浅黄色 |
| ii | 向i所得溶液中加入少量KSCN溶液,溶液呈浅红色,再加入H2O2溶液,产生无色气体(经检验为O2,溶液变为深红色) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2+2H2O→CH4+2O2 | B. | NaOH+HCl=NaCl+H2O | ||
| C. | Cu+2HCl=Cu Cl2+H2↑ | D. | 4Al+3O2+6H2O=4Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅与氢氧化钾溶液反应:Si+2OH-+H2O═SiO32-+2H2↑ | |
| B. | Al(OH)3溶于稀硝酸:OH-+H+═H2O | |
| C. | 往氨水中加入少量AlCl3溶液:Al3++4OH-═[Al(OH)4]- | |
| D. | 把水玻璃滴入盐酸中:SiO32-+2H+═H2SiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用SO2漂白纸浆和草帽辫 | |
| B. | SO2具有强还原性,浓硫酸具有强氧化性,故浓硫酸不能用于干燥SO2气体 | |
| C. | 将浓硫酸滴到蔗糖表面,固体变黑膨胀,说明浓硫酸有脱水性和强氧化性 | |
| D. | Na2SO3与H2O2的反应为氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
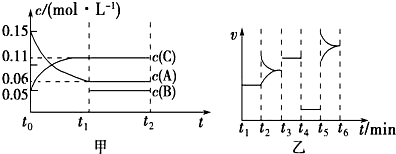
| A. | 若t1=15 s,t0~t1阶段B的平均反应速率为0.004 mol•L-1•s-1 | |
| B. | t4~t5阶段改变的条件是减小压强 | |
| C. | 该容器的容积为2 L,B的起始物质的量为0.02 mol | |
| D. | t5~t6阶段,容器内A的物质的量减少了0.06 mol,容器与外界的热交换为a kJ,则该反应的热化学方程式为3A(g)?B(g)+2C(g)△H=-50a kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
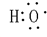 ;C22-(电子式)
;C22-(电子式) ;1,3-丁二烯(实验式)C2H3.
;1,3-丁二烯(实验式)C2H3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物稳定性:HF>HCl | B. | 碱性:NaOH>KOH | ||
| C. | 非金属性:P>Cl | D. | 酸性:H2SO4>HClO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com