
| A. | 可以用淀粉溶液检验加碘盐中是否含碘元素 | |
| B. | 水晶、玛瑙的主要成分是二氧化硅 | |
| C. | “白色污染”是指由不可降解的塑料造成的环境污染 | |
| D. | 硫和氮的氧化物是形成酸雨的主要物质 |
分析 A.淀粉遇碘单质变蓝;
B.根据水晶、玛瑙的主要成分来分析;
C.白色污染是人们对难降解的塑料垃圾污染环境现象的一种形象称谓,它是指用聚苯乙烯、聚丙烯、聚氯乙烯等高分子化合物制成的各类生活塑料制品使用后被弃置成为固体废物;
D.二氧化硫、氮的氧化物可使雨水的酸性增强.
解答 解:A.淀粉遇碘单质变蓝,而加碘盐中含碘酸钾,不是单质,不能用淀粉溶液检验加碘盐中是否含碘元素,故A错误;
B.水晶、玛瑙的主要成分是二氧化硅,故B正确;
C.白色污染是由废弃的各类生活难降解的塑料制品造成的,故C正确;
D.二氧化硫、氮的氧化物可使雨水的酸性增强,雨水pH<5.6为酸雨,所以形成酸雨的主要物质是硫的氧化物和氮的氧化物,故D正确;
故选A.
点评 本题考查常见的生活环境的污染及治理,把握酸雨、白色污染及碘单质的检验为解答的关键,注重化学与生活、环境保护的联系,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 物质(杂质) | 所用试剂 | 分离方法 |
| A | 溴苯(Br2) | 苯 | 萃取、分液 |
| B | 乙酸乙酯(乙酸) | 饱和碳酸钠溶液 | 分液 |
| C | CH4(C2H4) | 酸性高锰酸钾 | 洗气 |
| D | 硝基苯(硝酸) | 氢氧化钠溶液 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
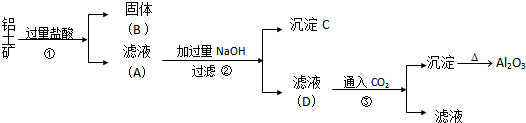
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2 L二氯甲烷( CH2Cl2)所含的分子数为0.5NA | |
| B. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA | |
| C. | 1mol羟基(-OH)所含的电子总数为10NA | |
| D. | 10g质量分数为46%的乙醇溶液中,氢原子的总数为1.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{12}^{24}$Mg和${\;}_{12}^{26}$Mg互为同位素 | B. | 氯原子的结构示意图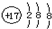 | ||
| C. | 氯化钠的电子式是 | D. | 乙酸与乙醇互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将12.00g胆矾配成500mL溶液 | |
| B. | 将12.50g胆矾溶于少量水中,再用水稀释至500mL | |
| C. | 称取7.68g硫酸铜,加入500mL水 | |
| D. | 在80mL0.6mol/L CuSO4溶液中加入400mL水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com