
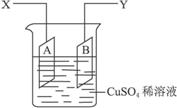
图4-35
(1)当以I=0.21 A的电流电解60 min后,测得铜片A的质量增加了0.25 g,则图装置中的X端应与直流电的________极相连,它是电解池的________极。
(2)电解后铜片B的质量___________(填“增加”“减少”或“不变”)。
(3)列式计算实验测得的阿伏加德罗常数NA。(已知电子电量e=1.60×10-19C)
 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:
 下图是元素R的单质及其重要化合物在一定条件下相互转化的关系图(生成物中不含该元素的物质均已略去).已知F可用作化肥,也可用来制炸药;G可用于作防腐剂或建筑工程上的抗冻剂.据此回答以下问题:
下图是元素R的单质及其重要化合物在一定条件下相互转化的关系图(生成物中不含该元素的物质均已略去).已知F可用作化肥,也可用来制炸药;G可用于作防腐剂或建筑工程上的抗冻剂.据此回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
1.《有机化学基础》
M5纤维是近年来开发出的一种超高性能纤维,它比现有的防爆破材料轻35%,可用于制头盔、防弹背心和刚性前后防护板。下图是有关M5纤维等有机物的转化关系图(部分反应未注明条件):
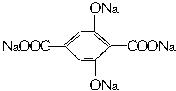
请回答:
(1)写出下列物质的结构简式F____________,H____________。B的氢的核磁共振谱图中有____________种类型的氢原子吸收峰。
(2)1 mol G与Na2CO3溶液反应,最多消耗Na2CO3____________ mol。
(3)指出下列反应的反应类型:A→B____________;G→M5____________。
(4)写出C→D反应的化学方程式:____________________________________________。
(5)试分析M5纤维具有极高强度的原因:_______________________________________。
2.《物质结构与性质》
有A、B、C、D、E原子序数均为前20号的五种元素,其中A元素和B元素的原子都有1个未成对电子,A+与B-具有相同的电子层结构,B原子得一个电子后2p轨道全满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等于其中子数。R是由A、D两元素形成的化合物;E元素原子中4s能级有2个电子。请回答:
(1)A单质、B单质、化合物R的熔点大小顺序为____________(填序号)。
①A单质>B单质>化合物R ②化合物R>A单质>B单质
③A单质>化合物R>B单质 ④B单质>化合物R>A单质
(2)B-的特征电子排布式为____________;在CB3分子中C元素原子的原子轨道发生的是____________杂化,其固态时的晶体类型为____________。
(3)C的氢化物的空间构型为____________,其氢化物在同族元素所形成的氢化物中沸点最高的原因是____________________________________________________________________。
(4)B、C、D三元素的电负性大小顺序为____________>____________>____________(填元素符号)。
(5)E与B形成的晶体M的最小单元“晶胞”如下图所示,则M的化学式为____________;如果M晶体的密度为d g·cm-3,阿伏加德罗常数为NA,则晶体中两个距离最近的E中心间的距离为____________ cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
有关元素A、B、C、D、E的信息如下:
| 元素 | 有关信息 |
| A | 元素主要化合价为-2,A的一种氢化物可用于实验室制取A的单质 |
| B | 所在主族序数与所在周期序数之差为4 |
| C | 原子中含10个P电子 |
| D | 最高价氧化物对应的水化物,能电离出电子数相等的阴、阳离子 |
| E | 生活中常见金属,它有两种氯化物,相对原子质量相差35.5 |
请回答下列问题:
 (1)元素A~E中两种元素组成的化合物使品红溶液褪色的物质的化学式为______。
(1)元素A~E中两种元素组成的化合物使品红溶液褪色的物质的化学式为______。
(2)E元素与B元素可形成EB2和EB3两种化合物,下列说法正确的是(填序号)________。
①保存EB2溶液时,需向溶液中加入少量E单质
②EB2只能通过置换反应生成,EB3只能通过化合反应生成
③铜片、碳棒和EB3溶液组成原电池,电子由铜片沿导线流向碳棒
④向淀粉碘化钾溶液和苯酚溶液中分别滴加几滴EY3的浓溶液,原无色溶液都变为紫色
(3)用化学符号表示D2C的水溶液中各粒子的浓度关系,如c(C2-)=______________。
(4)将一定量的B单质通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中含有三种含B元素的离子,其中两种离子的物质的量(n)与反应时间(t)的变化示意图如下图所示。该苛性钾溶液中KOH的质量是___________,该反应中转移电子的物质的量是_________。
(5)工业上冶炼E单质的化学方程式为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
甲醛是重要的有机合成原料,大量用于生产树脂、合成纤维、药物、涂料等,也是世界卫生组织(WHO)确认的致癌物和致畸物质之一。据中国室内环境监测工作委员会调查统计,中国新装家庭甲醛超标60%以上。我国规定室内空气中甲醛含量不得超过0.08 mg/m3。
(1)下列说法或做法不合理的是______________ 。(填字母)
a.用甲醛溶液浸泡水产品以长时间保持水产品的“新鲜”
b.刚装修的新房入住前房间内保持一定温度并注意通风
c.合成“吊白块”的反应NaHSO3+HCHO→NaO-CH2-SO3H是加成反应
d.福尔马林可用于制作动物标本(或保存尸体)
(2) 某研究性学习小组拟用甲醛法测定常见铵态氮肥的含氮量
〔资料:4NH4++6HCHO=(CH2)6N4H++3H++6H2O,所生成的H+和(CH2)6N4H+可用NaOH标准溶液滴定,采用酚酞作指示剂〕。
用甲醛法测定含氮量,不适合的铵盐是 ______________ 。(填字母)
a.NH4HCO3 b.(NH4)2SO4 c.NH4Cl
(3)工业制甲醛的两种方法如下(数据均为298.15 K下测定):
反应I:
CH3OH(g)→HCHO(g)+H2(g) ΔH1=+92.09kJ/mol,K1=3.92×10-11
反应II:
CH3OH(g)+1/2 O2(g)→HCHO(g)+H2O(g) ΔH2=-149.73kJ/mol,K2=4.35×1029
绿色化学提倡化工生产应提高原子利用率。
反应 __________(填“I”或“II”)制甲醛原子利用率更高。从反应的焓变和平衡常数K值看,反应_________(填“I”或“II”)制甲醛更加有利。
② 反应Ⅱ自发进行的条件是 __________(填字母)。
a.高温 b.低温 c.任何条件
③ 下图是甲醇制甲醛有关反应的lgK(平衡常数的对数值温度T的变化。图中曲线(1) 表示的是反应 _____(填“I”或“II”)。

(4)某研究性学习小组测定居室中甲醛的含量的原理如下:
4MnO4-+5HCHO+12H+=4Mn2++5CO2↑+11H2O

打开a,关闭b,用注射器抽取室内空气;关闭a,打开b,再推动注射器,将气体缓缓推入酸性KMnO4溶液中,使其充分反应。当B装置中____________________ ___________________时停止推气。若总共取样为50 L空气,则该居室内空气中甲醛的浓度 __________ mg/m3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com