
 Ⅰ.如图1为向25mL 0.1mol?L-1NaOH溶液中逐滴滴加0.2mol?L-1CH3COOH溶液过程中溶液pH的变化曲线.请回答:
Ⅰ.如图1为向25mL 0.1mol?L-1NaOH溶液中逐滴滴加0.2mol?L-1CH3COOH溶液过程中溶液pH的变化曲线.请回答:| 锥形瓶中溶液 | 滴定管中溶液 | 选用指示剂 | 选用滴定管 | |
| A | 碱 | 酸 | 酚酞 | (乙) |
| B | 酸 | 碱 | 甲基橙 | (甲) |
| C | 碱 | 酸 | 石蕊 | (甲) |
| D | 酸 | 碱 | 酚酞 | (乙) |
| 0.02mol |
| 0.2L |
| Kw |
| c(OH-) |
| 10-13 |
| 0.1 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HCO3-水解的离子方程式:HCO3-+H2O═CO32-+H3O+ | ||
| B、漂白粉溶液在空气中失效:ClO-+CO2+H2O=HClO+HCO3- | ||
| C、过量的SO2通入NaOH溶液中:SO2-+2OH-=SO32-+H2O | ||
D、新制氢氧化铜和乙醛反应:CH3CHO+2Cu(OH)2+OH-
|
查看答案和解析>>
科目:高中化学 来源: 题型:
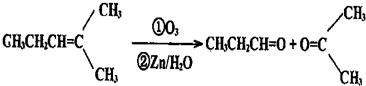

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、Na+、Cl-、CO32- |
| B、Cu2+、Cl-、Na+、SO42- |
| C、Ca2+、Na+、Cl-、NO3- |
| D、Na+、Ag+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入NaOH固体 |
| B、加入冰醋酸 |
| C、增大压强 |
| D、升高温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeCl3溶液中加入铁粉:Fe3++Fe=2Fe2+ |
| B、氯气通入苦卤(海水晒盐后得到的母液)中:Br-+C12=Br2+C1- |
| C、硫酸溶液中滴加氢氧化钡溶液:Ba2++2OH-+SO42-+2H+=BaSO4↓+2H2O |
| D、向烧碱溶液中滴加醋酸(CH3COOH):OH-+H+=H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com