
����Ŀ��ʵ������63%��Ũ���ᣨ���ܶ�Ϊ1.4g/mL������240mL0.50mol/Lϡ���ᣬ��ʵ�������У�A 10mL��Ͳ B 50mL��Ͳ C ������ƽ D ������ E 100mL����ƿ F 250mL����ƿ G 500mL����ƿ H ��ͷ�ι� I 200mL�ձ���
��1����Ũ��������ʵ���Ũ��Ϊ____________mol/L
��2��Ӧ��ȡ63%��Ũ����_____________mL��Ӧѡ��___________��(����������ĸ���)
��3��ʵ��ʱ����ѡ�õ�������______________������������ĸ��ţ�
��4�����ƹ����У����в�����ʹ���Ƶ�ϡ������ҺŨ��ƫ�ߵ���______������ţ��� |
A�������˽���Ľ�������ʹ������ƿ |
B�����ܰ��˽���Ľ�����Ϊ�ή������ƿ�ľ�ȷ�� |
C�����ؼӴ�ƿ������Ϊ������ƿ��ת��Һ��ʱ��������Һ�嵹��ƿ�⣬�������Һ��Ũ�Ȳ���̫��Ӱ�� |
���𰸡�14.0 8.9 A D��F��H��I �٢� B
��������
��1��Ũ��������ʵ���Ũ��=![]() =14.0mol/L��
=14.0mol/L��
��2������û��240����������ƿ��Ӧѡ��250����������ƿ������250������Һ������Ҫ��Ũ��������Ϊx������������Һϡ��ʽ���㣬14.0x=250��0.50 ��x=8.9�����ݴ������ԭ������Ҫ��ȡ��Ũ��������Ϊ8.9����������Ӧѡ��10��������Ͳ��ѡA��
��3���������Ʋ����Ǽ��㡢��ȡ��ϡ�͡���ȴ����Һ��ϴ�ӡ����ݡ�ҡ�ȡ�װƿ��֪�����������10��������Ͳ���ձ�����������250��������ƿ�ͽ�ͷ�ιܡ����Ի���ҪѡD��F��H��I��
��4������ȡŨ�������Ͳ������ˮϴ��2-3�Σ�����ϴ��Һת������ƿ���ᵼ�����ʵ���ƫ�࣬��Ũ��ƫ�ߡ�������ƿʹ��ʱδ�����Ũ��û��Ӱ�졣���ܽ��δ����ȴ����Һ������ȴ����Һ�����ƫС��Ũ��ƫ�ߡ��ܶ���ʱ��С������������ˮ�ε�ƿ�⣬�ᵼ�����ʵ���ʧ��Ũ��ƫ�͡��ݶ��ݺ���ҡ�ȡ����ã�����Һ����ڿ̶��ߣ��ټ�����ˮ�����̶��ߣ���Һ�����ƫ��Ũ��ƫ�͡�����ѡ�٢�
��5������ƿ��ƿ���Ĵ֣��ή������ƿ�ľ�ȷ�ȣ�ѡB��


 �����ߴ���ϵ�д�
�����ߴ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(ClO2)��һ�����������������۵�Ϊ��59 �棬�е�Ϊ 11 �棬Ũ�ȹ���ʱ�����ֽ⣬������ը���������Ⱦ���ǿ�̼��Ժ�ʴ�ԡ�ij������ȤС��ͨ�������� NaClO2��Һ��Ӧ����ȡ����ClO2��װ����ͼ��ʾ��
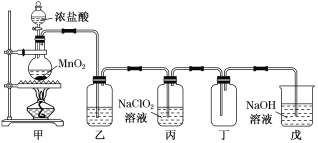
��1����װ����Բ����ƿ�ڷ�����Ӧ�Ļ�ѧ����ʽ��______________________________________��
��2��Cl������ʱ��� ClO2�����ɣ�������װ�ã����װ���ڲ��� ClO2���������Լӿ졣��װ�����Լ�ƿ�ڵ�Һ����__________��ʵ������г���ͨ�������� N2ϡ�� ClO2����Ŀ����_____________________________________________��
��3����װ���з����ķ�ӦΪ��Cl2��2NaClO2===2ClO2����2NaCl ��
�����йظ�ʵ���˵����ȷ����________________
A. �����ȷ����ʵ��װ�õ�������
B. �����װ����ʢ��Ũ���ᣬ��������ʵ�鰲ȫ
C. ����������MnO2�뺬0.4 molHCl��Ũ���ᷴӦ������п��Ƶ�0.2molClO2
D. ʵ����̼�װ��Ҫ�������ȣ�����ǿ��
��4����װ���ձ���NaOH ��Һ����������_________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���в������������ý�����ȷ����
ѡ�� | ���������� | ���� |
A | �����������䣬��СH2(g)+I2 (g) | ����ѹǿ��ƽ�������ƶ� |
B | ��������Һ�м��뼸��ϡ���ᣬˮԡ���ȼ����ӣ��������м������Ƶ�������Һ����ˮԡ���ȣ�δ�������� | ����δˮ�� |
C | ������Һ�м���CuSO4��Һ��Na2SO4������Һ����������ɫ���� | �����ʾ������˱��� |
D | ����������ͬʱ��Na2S2O3��Һ��ϡH2SO4��Ӧ��������Һ���¶ȣ��������������ʱ������ | ��������������ʱ�����߷�Ӧ�¶ȣ���ѧ��Ӧ���ʼӿ� |
A. AB. BC. CD. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͼ�ױ�ʾҶ����Ľṹ��ͼ�ұ�ʾ����Ӧ���̡����ͼ�ش��������⣺

(l)Ҷ�����е�ɫ�طֲ���ͼ���е�____ ������ţ�������ɫ��������ֽ���Ϸ��룬����Ϊ____��
(2)Ҷ������й������ʱ��ATP���ƶ������Ǵ�____��____������ţ����ϳ�ATP�������������____��
(3)�ڹ���ǿ�ȡ��¶Ⱥ�CO2Ũ�����ֻ��������У���ֱ��Ӱ��ͼ����ʾ���̵��� _________����ͻȻ������ǿ�ȣ����ڶ�ʱ����Ҷ������C3��C5�ĺ����仯�ֱ��� _________��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����¶ȡ��ݻ���ͬ��3���ܱ������У�����ͬ��ʽͶ�뷴Ӧ����ֺ��¡����ݣ���÷�Ӧ�ﵽƽ��ʱ���й���������[��֪N2(g)��3H2(g)![]() 2NH3(g)����H����92.4 kJ��mol��1]������˵����ȷ����(����)
2NH3(g)����H����92.4 kJ��mol��1]������˵����ȷ����(����)
���� | �� | �� | �� |
��Ӧ��Ͷ���� | 1 mol N2�� 3 mol H2 | 2 mol NH3 | 4 mol NH3 |
NH3��Ũ ��/mol��L��1 | c1 | c2 | c3 |
��Ӧ�������仯 | �ų�a kJ | ����b kJ | ����c kJ |
��ϵѹǿ(Pa) | p1 | p2 | p3 |
��Ӧ��ת���� | ��1 | ��2 | ��3 |
A. 2c1��c3B. ��1����3��1C. 2p2��p3D. a��b��92.4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���и��������У���������ͬ���ǣ�������
A.9g H2O �� 0.5NA �� CO2
B.2L CO �� 2L CO2
C.��״���� ��1mol O2 �� 22.4LCCl4
D.2g H2�ͱ�״���� 2.24L HCl ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ����գ�
��1�� ��ȥKNO3�л��е�SO42-Ӧѡ��ij����Լ�Ϊ__________��
��2�� ����ڵ�����ˮ�еμӱ���FeCl3��Һ����ȡFe(OH)3���壬�û�ѧ����ʽ��ʾ�÷�����ԭ����_______��
��3�� ��ˮ��Һ�У�KHSO4�ĵ��뷽��ʽΪ��______________________________��
��4�� ����������������Һ��Ӧ�����ӷ���ʽΪ��__________________________��
��5�� CO2����������ʯ��ˮ��Ӧ�����ӷ���ʽ��__________________________��
��6�� ����ͭ��Һ������������Һ��Ӧ�����ӷ���ʽΪ��____________________ ��
��7��С�մ���ΪʳƷ���������е����ɼ�������Һ��ϡHNO3��Ӧ�����ӷ���ʽΪ��___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����4NH3��g��+3O2��g��=2N2��g��+6H2O��g����H=��1269kJ/mol
��
����˵����ȷ����
A. �Ͽ�1 mol O��O���ȶϿ�1 mol N��N������������448kJ
B. �Ͽ�1 mol H��O���ȶϿ�1 mol H��N�������������Լ72.6kJ
C. �����ϼ��ܵ���Ϣ��֪H2O�ķе��NH3��
D. ��Ԫ�طǽ����Ե�ǿ����֪ HһO����HһN����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ��ش��������⣺
(1)3-��-2-��ϩ�Ľṹ��ʽΪ______________��
(2)ij���ķ���ʽΪC4H4�����Ǻϳ����м��壬���ж���ͬ���칹�塣
��д������һ����ʽ�ṹ��ͬ���칹��Ľṹ��ʽ(��ʾ��ͬһ��̼ԭ��������2��̼̼˫���Ľṹ���ȶ�)______________��
������һ��ͬ���칹�壬ÿ��̼ԭ�Ӿ��ﱥ�ͣ���̼��̼�ļн���ͬ���÷�����̼ԭ���γɵĿռ乹��Ϊ______________�Ρ�
(3)���л���A�����������г��ȼ�գ�ʵ���ã�����5.4g H2O��8.8g CO2����������6.72L(��״����)��������ʵ�ʵ��ʽ��__________��
(4)д���ɼױ���TNT�ķ���ʽ_________________________________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com