
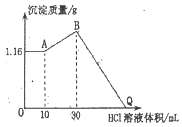
【题目】把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后产生1.16g白色沉淀,在所得的浊液中逐滴加入1 molL-1 HCl溶液,加入HCl溶液的体积与生成沉淀的质量关系如图所示。
请回答下列问题:
(1)B点的沉淀物的化学式为_____
(2)写出混合物溶于水时发生反应的离子方程式_____
(3)原混合物中MgCl2的物质的量为_____
(4)原固体混合物中NaOH的质量为_____
(5)Q点加入HCl溶液的体积为_____
【答案】Mg(OH)2、Al(OH)3 Mg2++2OH-=Mg(OH)2↓,Al3++4OH-=AlO2-+2H2O 0.02mol 5.20g 130mL
【解析】
(1)A-B段,盐酸和偏铝酸钠反应生成氢氧化铝沉淀;B点溶液中存在的溶质是氯化钠,沉淀为Mg(OH)2、Al(OH)3。
(2)固体混合物溶于水后所形成的溶液中加入盐酸,0-A时没有沉淀生成,说明溶液中NaOH过量,则铝离子完全转化为偏铝酸根离子,溶液中存在的沉淀为Mg(OH)2。
(3)A点沉淀的是氢氧化镁,则n(Mg(OH)2)=![]() =0.02mol,根据Mg原子守恒得n(MgCl2)=n[Mg(OH)2]。
=0.02mol,根据Mg原子守恒得n(MgCl2)=n[Mg(OH)2]。
(4)A-B段,盐酸和偏铝酸钠反应生成氢氧化铝沉淀,离子反应方程式为H2O+AlO2-+H+=Al(OH)3↓,根据HCl的体积知,n(AlO2-)=n(HCl)=1mol/L×(0.03-0.01)L=0.02mol,根据铝原子守恒得n(AlCl3)=n(AlO2-)=0.02mol,由Na+离子和Cl-离子守恒得,原混合物中n(NaOH)=n(NaCl)=n(Cl-)=2n(MgCl2)+3n(AlCl3)+n(HCl)。
(5)B-Q过程中,氢氧化镁和氢氧化铝都与盐酸反应生成氯化铝和氯化镁,所以Q点溶液中的溶质是氯化铝、氯化镁和氯化钠,实际上相当于氢氧化钠和盐酸的反应,所以二者恰好反应时,n(NaOH)=n(HCl)。
(1)A-B段,盐酸和偏铝酸钠反应生成氢氧化铝沉淀,离子反应方程式为H2O+AlO2-+H+=Al(OH)3↓,B点溶液中存在的溶质是氯化钠,沉淀为Mg(OH)2、Al(OH)3。答案为:Mg(OH)2、Al(OH)3;
(2)固体混合物溶于水后所形成的溶液中加入盐酸,0-A时没有沉淀生成,说明溶液中NaOH过量,则铝离子完全转化为偏铝酸根离子,溶液中存在的沉淀为Mg(OH)2,反应的离子方程式为Mg2++2OH-=Mg(OH)2↓,Al3++4OH-=AlO2-+2H2O。答案为:Mg2++2OH-=Mg(OH)2↓,Al3++4OH-=AlO2-+2H2O;
(3)A点沉淀的是氢氧化镁,则n(Mg(OH)2)=![]() =0.02mol,根据Mg原子守恒得n(MgCl2)=n[Mg(OH)2]=0.02mol。答案为:0.02mol;
=0.02mol,根据Mg原子守恒得n(MgCl2)=n[Mg(OH)2]=0.02mol。答案为:0.02mol;
(4)A-B段,盐酸和偏铝酸钠反应生成氢氧化铝沉淀,离子反应方程式为H2O+AlO2-+H+=Al(OH)3↓,根据HCl的体积知,n(AlO2-)=n(HCl)=1mol/L×(0.03-0.01)L=0.02mol,根据铝原子守恒得n(AlCl3)=n(AlO2-)=0.02mol,由Na+离子和Cl-离子守恒得,原混合物中n(NaOH)=n(NaCl)=n(Cl-)=2n(MgCl2)+3n(AlCl3)+n(HCl)=0.02mol×2+0.02mol×3
+0.03L×1mol/L=0.13mol,氢氧化钠的质量为:0.13mol×40g/mol=5.20g。答案为:5.20g;
(5)B-Q过程中,氢氧化镁和氢氧化铝都与盐酸反应生成氯化铝和氯化镁,所以Q点溶液中的溶质是氯化铝、氯化镁和氯化钠,实际上相当于氢氧化钠和盐酸的反应,所以二者恰好反应时,n(NaOH)=n(HCl),则V(HCl)=![]() =0.13L=130mL。答案为:130mL。
=0.13L=130mL。答案为:130mL。


科目:高中化学 来源: 题型:
【题目】按要求填空
(1)有下列物质:①铜;②石灰水;③CO2;④Fe(OH)3溶液;⑤CaO;⑥豆浆。其中属于胶体的是_____(填序号,下同),属于碱性氧化物的是_____
(2)在标准状况下,35.5g氯气的体积是_____L.将其与氢气化合,需氢气的物质的量是_____mol,将生成的气体溶于水,配成500mL溶液,则该溶液中溶质的物质的量浓度是_____mol/L
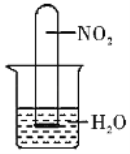
(3)如图所示,将充满NO2气体的试管倒扣在水槽中,观察到试管内气体颜色由_____色逐渐变为无色,最终试管内液面上升至试管容积的_____处(填分数)
查看答案和解析>>
科目:高中化学 来源: 题型:
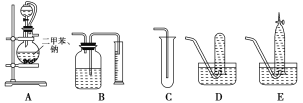
【题目】为了测定乙醇的结构式,有人设计了用无水酒精与钠反应的实验装置和测定氢气体积的装置进行实验。可供选用的实验仪器如图所示。
请回答以下问题:
(1)测量氢气体积的正确装置是________(填写编号)。
(2)装置中A部分的分液漏斗与蒸馏烧瓶之间连接的导管所起的作用是________(填写编号)。
A.防止无水酒精挥发
B.保证实验装置不漏气
C.使无水酒精容易滴下
(3)实验前预先将小块钠在二甲苯中熔化成小钠珠,冷却后倒入烧瓶中,其目的是
________________________________________________________________________。
(4)已知无水酒精的密度为0.789 g·cm-3,移取2.0 mL酒精,反应完全后(钠过量),收集390 mL气体。则乙醇分子中能被钠取代出的氢原子数为________,由此可确定乙醇的结构式为________________而不是____________________________________________________。
(5)实验所测定的结果偏高,可能引起的原因是________(填写编号)。
A.本实验在室温下进行
B.无水酒精中混有微量甲醇
C.无水酒精与钠的反应不够完全
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语对事实的表述不正确的是
A. 硬脂酸与乙醇的酯化反应:C17H35COOH+C2H518OH![]() C17H35COOC2H5+H218O
C17H35COOC2H5+H218O
B. 常温时,0.1 mol·L-1氨水的pH=11.1:NH3·H2O![]()
![]() +OH
+OH
C. 由Na和C1形成离子键的过程:![]()
D. 电解精炼铜的阴极反应:Cu2+ +2e![]() Cu
Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现以淀粉或乙烯为主要原料都可以合成乙酸乙酯,其合成路线如图所示。

(已知:2CH3CHO+O2![]() 2CH3COOH)
2CH3COOH)
(1)A中含有的官能团名称是______________;其中③的反应类型是______________;
⑥的反应类型是______________;
(2)写乙烯的电子式:_________________乙烯的结构简式:____________;
(3)写出下列反应的化学方程式:①__________________;⑤______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2008年,三鹿等多家乳制品企业为使蛋白质含量检测合格而加入三聚氰胺,使多名儿童患肾结石,实验室可用下列实验装置测定三聚氰胺的分子式。
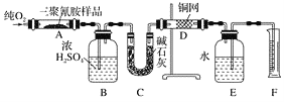
已知三聚氰胺的相对分子质量为126。取1.26 g三聚氰胺样品,放在纯氧中充分燃烧,生成二氧化碳、水、氮气,实验测得装置B增重0.54g,C增重1.32g,排入F中水的体积为672 mL(可按标准状况计算)。
(1)E装置的作用是_____。
(2)需要加热的装置是____(填字母代号)。
(3)装置D的作用是_____。
(4)F处读数时应该注意的是____、_____。
(5)三聚氰胺的分子式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 天然气、水煤气、液化石油气均是生活中常用的燃料,它们的主要成分都是化合物
B. “中国天眼”的“眼眶”是钢铁结成的圈梁,属于金属材料
C. 制玻璃和水泥都要用到石灰石原料
D. 1996年人工合成了第112号元素鎶(Cn),盛放鎶的容器上应该贴的标签是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年6月1日,陨石坠落西双版纳,再次引发了人们对“天外来客”的关注,下图中(部分产物已略去),X、Y、Z为单质,其它为化合物;E为陨石的主要成分,也是石英砂的主要成分;A为黑色磁性氧化物,请回答下列问题:
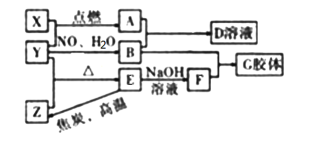
(1)关于E的说法正确的是___________________(填序号)
①E硬度大、熔点高、在自然界广泛存在
②E既能与NaOH溶液反应,又能与HF酸反应,其为两性物质
③可用盐酸除去E中混有少量X
④E是良好的半导体材料
(2)写出E与焦炭在高温下反应制取Z的化学方程式,并用单线桥分析标明电子转移数目______________
(3)写出E与NaOH溶液反应的离子方程式:_________________________________
(4)A与足量B的稀溶液反应生成D溶液,请用文字表述检验D中金属阳离子存在的一种实验方法_________
(5)F物质用氧化物的形式表示为:__________________。
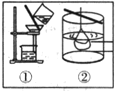
(6)已知在外加直流电作用下,G胶粒会向阳极区移动,这种现象叫做____________;净化G胶体可采用如图_____________(填序号)的方法,这种方法叫_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)某酸性工业废水中含有K2Cr2O7。光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+。某课题组研究发现,少量铁明矾[Al2Fe(SO4)4 ·4H2O]即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
(1)在25°C下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,作对比实验,完成以下实验设计表(表中不要留空格)。
实验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
① | 4 | B= | 10 | 30 |
② | 5 | 60 | 10 | d= |
③ | a= | 60 | c= | 20 |
测得实验①和②溶液中的Cr2O72-浓度随时间变化关系如图所示。
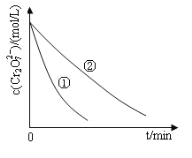
(2)上述反应后草酸被氧化为 (填化学式);
(3)实验①和②的结果表明_______________________________;
(4)该课题组对铁明矾[Al2Fe(SO4)4 ·4H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:Fe2+起催化作用;假设二: ;假设三: ;……
(5)请你设计实验验证上述假设一,完成下表中内容。(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4·Al2(SO4)3·24H2O、Al2(SO4)3等。(溶液中Cr2O72-的浓度可用仪器测定)
实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
取_______________________________代替实验①中的铁明矾,控制其他反应条件与实验①相同,进行对比实验 | 反应进行相同时间后, 若溶液中的Cr2O72-浓度____________________________则假设一成立; 若溶液中的Cr2O72-浓度____________________________则假设一不成立; |
(6)铁明矾长期存放,其中的亚铁离子可能会变质。为测定铁明矾中亚铁离子的质量分数。取5.6g铁明矾晶体,将其配制为100ml的溶液,取出20ml置于锥形瓶中。用0.01mol/L的标准KMnO4溶液进行滴定(还原产物为Mn2+),平行做4组实验,得出如下表数值。
组数 | 1 | 2 | 3 | 4 |
消耗V(KMnO4)/ml | 20.04 | 20.00 | 18.90 | 19.96 |
请计算铁明矾中亚铁离子的质量分数: 。若滴定结束后读数时仰视,测定结果 (填“偏大”“不影响”或“偏小”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com