
| A. | 用热的Na2CO3溶液去除油污:CO32-+H2O═HCO3-+OH- | |
| B. | 用FeS去除废水中的Hg2+:Hg2++S2-═HgS↓ | |
| C. | 用催化法处理汽车尾气中的CO和NO:CO+NO$\frac{\underline{\;催化剂\;}}{\;}$C+NO2 | |
| D. | 向污水中投放明矾,生成能凝聚悬浮物的胶体:Al3++3H2O?Al(OH)3(胶体)+3H+ |
分析 A.水解为可逆反应,且以第一步水解为主;
B.FeS在离子反应中保留化学式;
C.反应生成氮气和二氧化碳;
D.明矾水解生成胶体,可净化水.
解答 解:A.用热的Na2CO3溶液去除油污的水解离子反应为CO32-+H2O?HCO3-+OH-,故A错误;
B.用FeS去除废水中的Hg2+的离子反应为Hg2++FeS═HgS↓+Fe2+,故B错误;
C.用催化法处理汽车尾气中的CO和NO的离子反应为2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2,故C错误;
D.向污水中投放明矾,生成能凝聚悬浮物的胶体的水解反应为Al3++3H2O?Al(OH)3(胶体)+3H+,故D正确;
故选D.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应、离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意水解反应的书写方法,题目难度不大.


科目:高中化学 来源: 题型:解答题
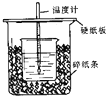 (1)在如图所示的装置中,50mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液进行中和反应,通过测定该反应过程中所放出的热量可计算中和热.回答下列问题:
(1)在如图所示的装置中,50mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液进行中和反应,通过测定该反应过程中所放出的热量可计算中和热.回答下列问题:| 实验序号 | A | B | C |
| 加入试剂 | KMnO4、H2C2O4 | KMnO4、H2C2O4 1gMnSO4粉末 | KMnO4、H2C2O4 1gNa2SO4粉末 |
| 完全褪色时间/s | 116 | 6 | 117 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol H2与0.5 molO2反应放出的热就是H2的燃烧热 | |
| B. | 1 mol H2SO4与1 molBa(OH)2反应时放出的热叫做中和热 | |
| C. | 热化学方程式中的化学计量数表示物质的量,可以是分数 | |
| D. | △H>0表示放热反应,△H<0 表示吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
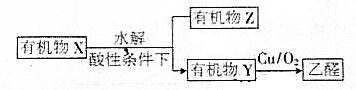
| A. | X可能是淀粉或纤维素 | B. | Y与CH3OCH3互为同分异构体 | ||
| C. | Z可能含有多个羧基 | D. | X中含有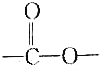 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉、纤维素、蛋白质都是天然高分子化合物,都能发生水解反应 | |
| B. | 蔗糖和葡萄糖不是同分异构体,但属同系物 | |
| C. | 苯酚、甲醛通过加聚反应可制得酚醛树脂 | |
| D. | 石油裂解和煤的干馏都是化学变化,而石油的分馏和煤的气化都是物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 0.1mol羟基中含有1 mol电子 | |
| B. | 乙烷和丙烯任意比混合的气体1mol,完成燃烧均生成3molH2O | |
| C. | CH2Cl2具有两种同分异构体 | |
| D. | 图中有机物(1-甲基环己烷)的一氯代物有4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | B烧杯中加一定量的KCl固体可使溶液恢复原状 | |
| B. | c电极周围溶液变红 | |
| C. | A烧杯内Cu2+浓度降低 | |
| D. | d电极上可以析出使湿润的淀粉KI试纸变蓝的气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com