
【题目】为了除去粗盐中Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作。
①过滤 ②加过量的NaOH ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液
其中正确的操作顺序是
A.①④②⑤③ B.④①②⑤③
C.②⑤④①③ D.⑤①④②③
 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:
【题目】 以下三组溶液:①煤油和硫酸钾溶液 ②42%的乙醇溶液 ③氯化钠和单质碘的水溶液,分离以上各混合液的正确方法依次是
A.分液、萃取、蒸馏 B.萃取、蒸馏、分液
C.分液、蒸馏、萃取 D.蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4,主要流程如下:

(1)写出AlCl3与氨水反应的化学反应方程式_________________________。
(2)判断流程中沉淀是否洗净所用的试剂是 ,高温焙烧时,用于盛放固体的仪器名称是 。
Ⅱ、无水AlCl3(183 ℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。

(3)其中装置A用来制备氯气,写出其离子反应方程式:______________________。
(4)装置B中盛放饱和NaCl溶液,该装置的主要作用是__________________________。
(5)F中试剂是________。G为尾气处理装置,其中反应的化学方程式:__________________。
(6)制备氯气的反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:与足量AgNO3溶液反应,称量生成的AgCl质量。此方案 (填“可行”,“不可行”),理由是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠有多种化合物,如氧化钠、过氧化钠、氢氧化钠、碳酸钠、碳酸氢钠等等,这些物质在实际生活中有广泛的应用,一定条件下相互间能进行转化。完成下列计算:
(1)将7.8 g Na2O2完全溶于93.8 g水中,所得溶液中溶质的质量分数为________。
(2)将11.6 g二氧化碳和水蒸气的混合物与足量的Na2O2充分反应,固体质量增加了3.6 g,则原混合气体的平均相对分子质量为________。
(3)向100 mL NaOH溶液中通入CO2充分反应后,在减压和较低温度下,小心地将溶液蒸干,得到白色固体M(不含结晶水)。通入二氧化碳的体积V(标准状况下)与M的质量W的关系如下图所示。

(a)推断b点时M的组成成分___________________。(填化学式,下同)
(b)若向b点的盐溶液中只加入0.03 mol某钠的化合物,充分反应后,减压低温蒸发得到无水Na2CO3 8.48 g,则加入的物质可以是________或________。
(4)将31 g NaOH和NaHCO3的固体混合物,在密闭容器中加热到250 ℃,经充分反应后排出气体、冷却,称得剩余固体的质量为N g,试分析不同N值时,剩余固体的组成成分(已知NaHCO3的分解温度低于250 ℃)__________ ____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列变化中,按氮元素被还原、被氧化、既被氧化又被还原、既不被氧化又不被还原的顺序排列正确的是( )
①大气通过闪电固氮 ②硝酸分解 ③实验室用氯化铵和消石灰制取氨气 ④二氧化氮溶于水中
A. ①②③④ B. ②④①③
C. ①③④② D. ②①④③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列框图所示的物质转化关系中,甲是日常生活中常见的金属,乙、丙、丁是常见的气体单质。气体B与气体C相遇产生大量的白烟生成E,A是强碱,D是海水中浓度最高的盐(部分反应物和生成物及水已略去)。
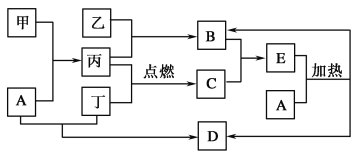
请回答下列问题:
(1)写出乙与丙生成B的反应条件:________________。
(2)写出甲和A溶液反应的离子方程式:______________。
(3)检验E中的阳离子时,取少量E于试管中, 则证明E中有该阳离子。
(4)写出实验室制取B的化学方程式:________________。
(5)B常见用途:_______________、_______________、_______________。
(6)常用作工业制某酸的原料,写出由B制该酸过程中的化学方程式:
______________________、 、________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业在现代农业、国防工业中,有着重要的地位。已知:N2(g)+3H2(g)![]() 2NH3(g)ΔH=-92kJ·mol-1。
2NH3(g)ΔH=-92kJ·mol-1。
(1)下列有关该反应速率的叙述,正确的是 。
a.升高温度可以增大活化分子百分数,加快反应速率
b.增大压强不能增大活化分子百分数,但可以加快反应速率
c.使用催化剂可以使反应物分子平均能量升高,加快反应速率
d.在质量一定的情况下,催化剂颗粒的表面积大小,对反应速率有显著影响
(2)该反应的化学平衡常数表达式为K=_________________。
(3)某温度下,若把10 mol N2与30 mol H2 置于体积为10 L的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为20%,则该温度下反应的K= (用分数表示)。
(4)对于合成氨反应而言,下列有关图像一定正确的是_____________。
a. b.
b. c.
c.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关金属腐蚀的论述,正确的是( )
A. 金属的腐蚀一定伴有电流产生
B. Fe在干燥的空气里比在潮湿的空气里更易被腐蚀
C. 发生化学能转变为电能的腐蚀时较活泼的金属总是作正极而被腐蚀
D. 发生电化腐蚀时都有能量的转变,且被腐蚀的金属总是失电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1.505×1023个X气体分子的质量为8g,则X气体的摩尔质量是( )
A.16g B.32g C.64g /mol D.32g /mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com