
科目:高中化学 来源: 题型:
【题目】有关SO2的性质,下列说法不正确的是
A. 能使品红溶液褪色 B. 能与NaOH溶液反应
C. 能与H2O反应生成H2SO4 D. 一定条件下能与O2反应生成SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某模拟“人工树叶”的电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法错误的是
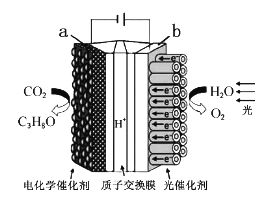
A. 该装置工作时,H+从b极区向a极区迁移
B. 每生成1molO2,有44gCO2被还原
C. a电极的反应式为3CO2+18H++18e-=C3H8O+5H2O
D. C3H8O和O2形成燃料电池以氢氧化钠作为电解质溶液的负极反应式:C3H8O-18e-+24OH-=3CO32-+16H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铈(58Ce)常用于制作稀土磁性材料,可应用于制造玻璃、打火石、陶瓷和合金等。已知:Ce4++Fe2+=Ce3++Fe3+。下列说法正确的是( )
A. Ce元素位于元素周期表第六周期第IIIB族
B. ![]() 、
、![]() 是同素异形体
是同素异形体
C. 铈能溶于HI溶液,发生反应的离子方程式为:Ce+4H+=Ce4++2H2
D. 铈的原子核外有58个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应在生产、生活中应用广泛。下列反应不属于氧化还原反应的是
A. 木炭燃烧:C + O2![]() CO2
CO2
B. 煅烧石灰石:CaCO3 ![]() CaO + CO2 ↑
CaO + CO2 ↑
C. 铁的冶炼:Fe2O3+3CO![]() 2Fe+3CO2
2Fe+3CO2
D. 电解水: 2H2O ![]() 2 H2 ↑ + O2 ↑
2 H2 ↑ + O2 ↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氟酸是一种弱酸,可用来刻蚀玻璃。
已知25℃时:①HF(aq)+OH-(aq)=F-(aq)+H2O(1)ΔH=-67.7kJ·mol-1,②H+(aq)+OH-(aq)=H2O(1) ΔH=-57.3kJ·mol-1。在20mL0.1mol·L-1氢氟酸中加入VmL0.1mol·L-1NaOH溶液,下列有关说法不正确的是
A. 氢氟酸的电离方程式及热效应可表示为: HF(aq)![]() F-(aq)+ H+(aq) ΔH=-10.4kJ·mol-1
F-(aq)+ H+(aq) ΔH=-10.4kJ·mol-1
B. 当V=20时,溶液中:c(OH-)=c(HF)+c(H+)
C. 当V=20时,溶液中:c(F-)<c(Na+)=0.1mol·L-1
D. 当V>0时,溶液中可能存在:c(Na+)>c(F-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象或图象信息不能充分说明相应化学反应是放热反应的是( )
A | B | C | D | |
反应装置图或图象 |
|
|
|
|
实验现象 | 温度计的水银柱不断上升 | 反应物总能量大于生成物总能量 | 反应开始后,甲处液面低于乙处液面 | 反应开始后,针筒活塞向右移动 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图是元素周期表的一部分,请回答下列问题。
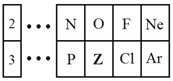
(1)Z元素在元素周期表中位于第________族。
(2)Z的原子半径__________(填“大于”、“小于”或“等于”)Si的原子半径。
(3)Cl元素的非金属性比Z元素的__________(填“强”或“弱”)。
(4)Z元素的气态氢化物的化学式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳是引起“温室效应”的主要物质,应该减少二氧化碳的排放。
(1)有一种用CO2生产甲醇燃料的方法:
已知:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-a kJmol-1;
CH3OH(g)═CH3OH(l)△H=-b kJmol-1;
2H2(g)+O2(g)═2H2O(g)△H=-c kJmol-1;
H2O(g)═H2O(l)△H=-d kJmol-1,
则表示CH3OH(l)燃烧热的热化学方程式为:_______________。
(2)在一定温度下的2L固定容积的密闭容器中,通入2mol CO2和3mol H2,发生的反应为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H<0,测得CO2(g)和CH3OH(g)的浓度随时间变化如右图所示。
CH3OH(g)+H2O(g)△H<0,测得CO2(g)和CH3OH(g)的浓度随时间变化如右图所示。
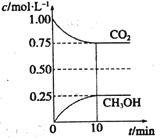
①从0min到10min,v(H2)=______。
②下列措施中能使![]() 增大的是______(选3填编号)。
增大的是______(选3填编号)。
A.升高温度 B.恒温恒容下充入He(g)
C.将H2O(g)从体系中分离 D.恒温恒容再充入2mol CO2和3mol H2
③计算该温度下此反应的平衡常数K=______(填分数或保留两位有效数字)。若改变______条件(填编号),可使K=1。
A.增大压强 B.增大反应物浓度 C.降低温度 D.升高温度 E.加入催化剂
(3)某甲醇燃料电池原理如图1所示
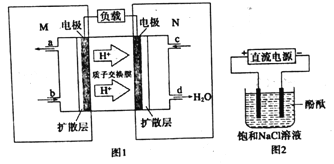
①则M区发生的电极反应式为______。
②用上述电池做电源,用图2装置电解饱和食盐水(电极均为惰性电极).则该电解反应的总反应的离子方程式为:__________________。
假设溶液体积为300mL,当溶液的pH值为13时(在室温下测定),理论上消耗甲醇的质量为______(忽略溶液体积变化)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com