
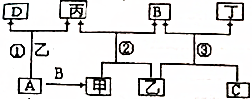
 2:1.
2:1. 分析 A、B、C、D为单质,其中B、C、D在常温常压下为气体,甲、乙、丙为常见化合物,甲、丙的焰色反应均为黄色,则甲、丙中含有钠元素,则A为Na,Na和O2反应生成Na2O2,Na2O2和H2O反应生成NaOH和O2,Na和H2O反应生成NaOH和H2,则B是O2、甲是Na2O2、乙是H2O、丙是NaOH、D是H2,H2O和C反应生成O2和丁,H2O和F2反应生成HF和O2,则C是F2,丁是HF,据此分析解答.
解答 解:A、B、C、D为单质,其中B、C、D在常温常压下为气体,甲、乙、丙为常见化合物,甲、丙的焰色反应均为黄色,则甲、丙中含有钠元素,则A为Na,Na和O2反应生成Na2O2,Na2O2和H2O反应生成NaOH和O2,Na和H2O反应生成NaOH和H2,则B是O2、甲是Na2O2、乙是H2O、丙是NaOH、D是H2,H2O和C反应生成O2和丁,H2O和F2反应生成HF和O2,则C是F2,丁是HF,
(1)通过以上分析知,A、丙的化学式分别为Na、NaOH,故答案为:Na;NaOH;
(2)有关反应的方程式:②为过氧化钠和水的反应,反应方程式为2Na2O2+2H2O=4NaOH+O2↑、③为水和氟气的置换反应,生成HF和氧气,反应方程式为
2H2O+2F2=4HF+O2,丁是HF,丙是NaOH,二者发生中和反应生成NaF和水,离子反应方程式为HF+OH-=F-+H2O,
故答案为:2Na2O2+2H2O=4NaOH+O2↑;2H2O+2F2=4HF+O2;HF+OH-=F-+H2O;
(3)①②反应方程式分别为2Na+2H2O=2NaOH+H2↑、2Na2O2+2H2O=4NaOH+O2↑,
若①②反应中生成的气体恰好反应完,且氢气和氧气按2:1的物质的量进行反应,如果①中生成2mol氢气,则转移电子物质的量为4mol,②中生成1mol氧气,转移电子物质的量为2mol,则①②反应转移的电子数目比为4mol:2mol=2:1,
故答案为:2:1.
点评 本题以钠及其化合物为载体考查无机物推断,为高频考点,涉及物质推断、根据方程式进行计算等知识点,易错点是C单质的判断,教材中没有氟气和水的反应导致学生判断C物质成分较困难,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | c(OH-)=c(Na+)+c(H+) | |
| B. | 由水电离出的c(OH-)=1.0×10-12mol•L-1 | |
| C. | 与等体积pH=2的醋酸混合后所得溶液显碱性 | |
| D. | 与等体积0.01 mol•L-1氯化铵溶液混合后所得溶液中:c(Na+)>c(NH4+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
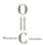 .根据上述信息,回答下列问题:
.根据上述信息,回答下列问题: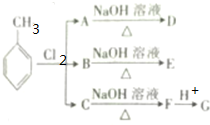
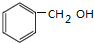 .
.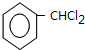 +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$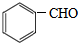 +2NaCl+H2O.
+2NaCl+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H=-600.4kJ/mol | B. | △H=-1081.6kJ/mol | ||
| C. | △H=+90.8kJ/mol | D. | △H=-90.8kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com