
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、RO3n-中R的化合价为+5价,n=1 |
| B、R位于元素周期表中的第VA族 |
| C、R的氢化物的水溶液和它的氧化物的水化物均呈酸性 |
| D、R的最外层电子为7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
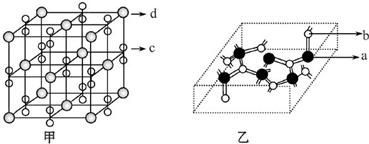
查看答案和解析>>
科目:高中化学 来源: 题型:
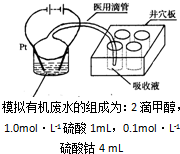 汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NO2等有毒气体,其污染问题也成为当今社会急需解决的问题.
汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NO2等有毒气体,其污染问题也成为当今社会急需解决的问题.查看答案和解析>>
科目:高中化学 来源: 题型:

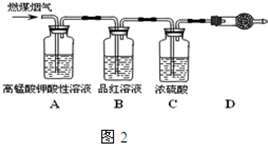
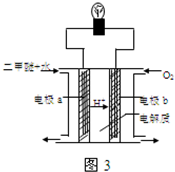 (4)在压强为0.1MPa条件下,容积为V L的密闭容器中a mol CO与2a mol H2在催化剂作用下反应生成甲醇CO(g)+2H2(g)═CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则:
(4)在压强为0.1MPa条件下,容积为V L的密闭容器中a mol CO与2a mol H2在催化剂作用下反应生成甲醇CO(g)+2H2(g)═CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
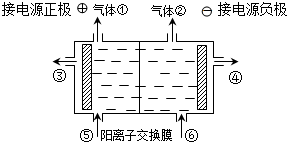
查看答案和解析>>
科目:高中化学 来源: 题型:
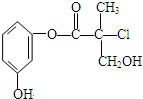 某有机物A是农药生产中的一种中间体,其结构简式如下图.则下列叙述正确的是( )
某有机物A是农药生产中的一种中间体,其结构简式如下图.则下列叙述正确的是( )| A、有机物A属于芳香烃 |
| B、1molA和足量的NaOH溶液反应,最多可以消耗4mol NaOH |
| C、有机物A和浓硫酸混合加热,可以发生消去反应 |
| D、有机物A可以和Br2的CCl4溶液发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、太阳能电池板中的硅在元素周期表中处于金属与非金属的交界位置 |
| B、常用的自来水消毒剂有氯气和二氧化氯,两者都含有极性键 |
| C、在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 |
| D、在车排气管上加装“催化转化器”是为了减少有害气体的排放 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com