
【题目】下列有关σ键和π键的说法错误的是
A. 在某些分子中,化学键可能只有σ键而没有π键
B. 分子中σ键的键能一定大于π键的键能
C. σ键的特征是轴对称,π键的特征是镜面对称
D. SO2形成π键与O3的π键是相似的
科目:高中化学 来源: 题型:
【题目】关于下列物质的用途的说法错误的是( )
A. 乙二醇可用于配制汽车防冻液
B. 酚类化合物有毒,不能用于杀菌、消毒
C. 部分卤代烃可用作灭火剂
D. 甲醛的水溶液(福尔马林)可用于防腐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铝分别和O2、O3发生反应生成Al2O3,反应过程和能量关系如下图所示(图中的ΔH表示生成1 mol产物的数据)。下列有关说法中不正确的是

A. Al(s)与O3(g)反应的热化学方程式为2Al(s)+O3(g)![]() Al2O3(s) ΔH =-1559.5 kJ·mol-1
Al2O3(s) ΔH =-1559.5 kJ·mol-1
B. 等质量的O2比O3的能量低
C. 1 mol O2完全转化为O3,需吸收142 kJ的热量
D. 给3O2(g)![]() 2O3(g)的平衡体系加热,有利于O3的生成
2O3(g)的平衡体系加热,有利于O3的生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向1 L含0.01 mol NaAlO2和0.02 mol NaOH的溶液中缓慢通入CO2,随n(CO2)增大,先后发生三个不同的反应,当0.01 mol<n(CO2) ![]() 0.015时发生的反应是:2 NaAlO2+ CO2+3H2O=2Al(OH)3↓+Na2CO3。下列对应关系正确的是
0.015时发生的反应是:2 NaAlO2+ CO2+3H2O=2Al(OH)3↓+Na2CO3。下列对应关系正确的是
选项 | n(CO2)/mol | 溶液中离子的物质的量浓度 |
A | 0 | c(Na+)>c(AlO2-)+c(OH-) |
B | 0.01 | c(Na+)>c(AlO2-)> c(OH-)>c(CO32-) |
C | 0.015 | c(Na+)> c(HCO3-)>c(CO32-)> c(OH-) |
D | 0.03 | c(Na+)> c(HCO3-)> c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究电化学腐蚀及防护的装置如图所示。下列有关说法错误的是( )
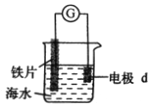
A. d为石墨,铁片腐蚀加快
B. d为石墨,石墨上电极反应为:O2+2H2O+4e ═ 4OH-
C. d为锌块,铁片不易被腐蚀
D. d为锌块,铁片上电极反应为:2H++2e ═ H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳和氮是动植物体中的重要组成元素,向大气中过度排放二氧化碳会造成温室效应,氮氧化物会产生光化学烟雾,目前,这些有毒有害气体的处理成为科学研究的重要内容。
用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)![]() N2(g)+CO2(g) △H<0。在T1℃时,反应进行到不同时间测得各物质的浓度如表所示:
N2(g)+CO2(g) △H<0。在T1℃时,反应进行到不同时间测得各物质的浓度如表所示:
时间/t | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
(1)10~20 min内,NO的平均反应速率![]() (NO)=______________,T1℃时,该反应的平衡常数K=___________________。
(NO)=______________,T1℃时,该反应的平衡常数K=___________________。
(2)30min后,只改变某一条件,反应重新达到平衡,根据表中的数据判断改变的条件可能是_______(填写相应的字母)。
a.通入一定量的NO b.加入一定量的C
c.适当升高反应体系的温度 d.加入合适的催化剂
(3)若保持与上述反应前30min的反应条件相同,起始时NO的浓度为2.50mol·L-1,则反应达平衡时c(NO)=_________mol·L-1,NO的转化率__________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究含氮污染物的治理是环保的一项重要工作。合理应用和处理氮的化合物,在生产生活中有重要意义。

(l)T℃时,将0.6mol NO和0.2 mol O3气体充入到2L固定容积的恒温密闭容器中,NO的浓度随反应时间的变化如图甲所示。
①T℃时,反应3NO(g)+O3(g) ![]() 3NO2(g)的平衡常数K=________.
3NO2(g)的平衡常数K=________.
②不能说明反应达到平衡状态的是_________(填序号).
A.气体颜色不再改变
B.气体的平均摩尔质量不再改变
C.气体的密度不再改变
D.单位时间内生成O3和NO2物质的量之比为1:3
(2)已知2NO2![]() N2O4,如图乙所示,A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的透明气囊,关闭K2,各将1molNO2通过K1、K3分别充入真空A、B中,反应起始时A、B的体积相同均为
N2O4,如图乙所示,A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的透明气囊,关闭K2,各将1molNO2通过K1、K3分别充入真空A、B中,反应起始时A、B的体积相同均为![]() L(忽略导管中的气体体积).
L(忽略导管中的气体体积).

①若容器A中到达平衡所需时间![]() s,达到平衡后容器内压强为起始压强的0.8倍,则平均化学反应速率
s,达到平衡后容器内压强为起始压强的0.8倍,则平均化学反应速率![]() _____________________.
_____________________.
②若打开K2,平衡后B容器的体积缩至0.4![]() L,则打开K2之前,气球B体积为_________L.
L,则打开K2之前,气球B体积为_________L.
③若平衡后在A容器中再充入0.5molN2O4,则重新到达平衡后,平衡混合气中NO2的体积分数___________(填“变大”“变小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将1 mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为ΔH1,将1 mol 的CuSO4(s)溶于水会使溶液温度升高,热效应为ΔH2,CuSO4·5H2O 受热分解的化学方程式为:CuSO4·5H2O(s)![]() CuSO4(s)+5H2O(l),热效应为ΔH3。则下列判断正确的是
CuSO4(s)+5H2O(l),热效应为ΔH3。则下列判断正确的是
A.ΔH2>ΔH3 B.ΔH1>ΔH3
C.ΔH1+ΔH3=ΔH2 D.ΔH1+ΔH2=ΔH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com