
【题目】某研究小组拟用定量的方法测量Al和Fe分别与酸反应的快慢,设计了如图1所示的装置。
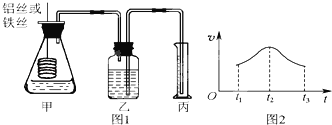
(1)检查图1所示装置气密性的方法是 。
(2)若要比较产生气体的快慢,可以测量相同时间段内产生气体的体积,也可以测量 。
(3)实验测得铝丝产生气体的速率(v)与时间(t)的关系如图2所示,则t1~t2时间段内反应速率逐渐加快的主要原因是 ;t2~t3时间段内反应速率逐渐减慢的主要原因是 。
【答案】(1)用手捂住锥形瓶,观察乙中长导管内液面是否上升;
(2)产生相同体积的气体所需时间;
(3)反应放热,溶液温度升高使反应速率加快,氢离子浓度减少反应速率减慢。
【解析】
试题分析:(1)检查图1所示装置气密性的方法是用手捂住锥形瓶,观察乙中长导管内液面是否上升。
(2)若要比较产生气体的快慢,可以测量相同时间段内产生气体的体积,也可以测量产生相同体积的气体所需时间。
(3)金属与酸反应放热,体系温度升高,则t1~t2时间段内反应速率逐渐加快的主要原因是反应放热,溶液温度升高使反应速率加快;随着反应的进行,酸的浓度逐渐降低,化学反应速率减慢,t2~t3时间段内反应速率逐渐减慢的主要原因是氢离子浓度减少反应速率减慢。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】分类是化学学习和研究的常用手段,下列分类依据和结论都正确的是
A. 冰醋酸、纯碱、铜绿、生石灰分别属于酸、碱、盐、氧化物
B. HClO、H2SO4(浓) 、HNO3均具有强氧化性,都是氧化性酸
C. Al、Al2O3、Al(OH)3均既能与盐酸反应又能与氢氧化钠反应,都属于两性化合物
D. H2SO4、NaOH、AlCl3均为强电解质,都属于离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以A、B为原料制备线型高分子化合物M和抗凝血药N的一种路线如下(部分反应条件和试剂略去):

已知:I. 烃A的密度是相同条件下H2密度的14倍;
I.![]()
II. ![]()
请回答下列问题:
(1)B的化学名称为____。F的结构简式为______。
(2)N中含氧官能团的名称为 _______。
(3)D→E的反应类型为_____。
(4)I的核磁共振氢谱中有_______组吸收峰。G分子中最多有____个原子共平面。
(5)B+C→M的化学方程式为_______。
(6)同时满足下列条件的J的同分异构体有_____种(不考虑立体异构)。
①苯环上连有2个取代基
②1mol该物质与足量的NaHCO3反应,生成2molCO2
(7)参照上述信息和合成路线,以HO![]() CH3和(CH3CO)2O为起始原料(其他无机试剂任选),设计制备
CH3和(CH3CO)2O为起始原料(其他无机试剂任选),设计制备![]() 的合成路线 _______。
的合成路线 _______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种安全杀菌消毒效率高的水处理剂。通过如下反应可制得ClO2:2NaClO3+H2SO4+SO2===2ClO2+2NaHSO4。下列叙述正确的是
A. NaClO3是还原剂 B. SO2被还原
C. NaClO3发生氧化反应 D. H2SO4既不是氧化剂,也不是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作均要用玻璃棒,其中玻璃棒的作用及其目的相同的是
① 过滤 ② 蒸发 ③ 溶解 ④ 向容量瓶转移液体
A. ①和② B. ①和③ C. ③和④ D. ①和④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是
A. 1mol O的质量是32g·mol-1 B. OH-的摩尔质量是17 g
C. 1mol H2O的质量18g·mol-1 D. CO2的摩尔质量是44g·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下列各组物质按酸、碱、盐分类顺序排列,正确的是( )
A.H2SO4 Na2CO3 Ca(OH)2
B.HCl NaOH K2CO3
C.H2CO3 C2H5OH NaHSO4
D.Ba(OH)2 H3PO4 KOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaCl是一种化工原料,可以制备一系列物质(如图)。下列说法正确的是()

A. 25℃,NaHCO3在水中的溶解度比Na2CO3的大
B. 石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂
C. 常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应
D. 如图所示转化反应都是氧化还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com