
【题目】当光束通过下列分散系时,能观察到丁达尔效应的是( )
A. 食盐水 B. 稀硫酸 C. CuSO4 溶液 D. 稀豆浆
科目:高中化学 来源: 题型:
【题目】工业上以铬铁矿(主要成分为FeOCr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O72H2O),其主要反应为: ①4FeOCr2O3+8Na2CO3+7O2 ![]() 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
②2Na2CrO4+H2SO4Na2SO4+Na2Cr2O7+H2O
下列说法中正确的是( )
A.反应①和②均为氧化还原反应
B.反应①的氧化剂是O2 , 还原剂是FeOCr2O3
C.高温下,O2的氧化性大于Fe2O3小于Na2CrO4
D.生成1mol的Na2Cr2O7时共转移5mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酰苯胺作为一种常用药,具有解热镇痛的效果.实验室制备乙酰苯胺时,可以用苯胺与乙酸酐或与冰醋酸加热来制取,苯胺与乙酸酐的反应速率远大于与冰醋酸反应的速率,已知苯胺微溶于冷水;纯乙酰苯胺是无色片状晶体,熔点114℃,不溶于冷水,可溶于热水;乙酸酐遇水缓慢反应生成乙酸;现选用苯胺与乙酸酐为原料制取和提纯乙酰苯胺,该放热反应的原理:
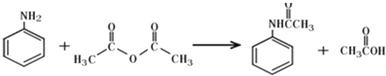
实验步骤
①取5.0mL苯胺(密度1.04g/mL),倒入100mL锥形瓶中,加入20mL水,在旋摇下分批加入6.0mL乙酸酐(密度1.08g/mL),搅拌均匀.若有结块现象产生,用玻璃棒将块状物研碎,再充分搅拌;
②反应完全后,及时把反应混合物转移到烧杯中,冷却后,抽滤,洗涤,得粗乙酰苯胺固体;
③将粗产品转移至150mL烧杯中,加入适量水配制成80℃的饱和溶液,再加入过量20%的水.稍冷后,加半匙活性炭,搅拌下将溶液煮沸3~5min,过滤Ⅰ,用少量沸水淋洗烧杯和漏斗中的固体,合并滤液,冷却结晶,过滤Ⅱ、洗涤、晾干得乙酰苯胺纯品.
(1)步骤①研碎块状产物的用意在于________________________________;反应温度过高会导致苯胺挥发,下列可以控制反应温度,防止反应温度升高过快的操作有__;
A.反应快结束时的充分搅拌 B.旋摇下分批加入6.0mL乙酸酐
C.玻璃棒将块状物研碎 D.加20mL水
(2)步骤②洗涤粗产品时,选用的溶剂是_______;
A.热水 B.冷水 C.1:3的乙醇溶液 D.滤液
(3)步骤③两次用到过滤,其中过滤Ⅰ选择________(过滤、趁热过滤或抽滤),过滤Ⅰ操作是为了除去_____________;配制热溶液时,加入过量溶剂的作用是___________(选出正确选项);
A.防止后续过程中,溶剂损失可能产生的产物析出
B.防止后续过程中,温度降低可能产生的产物析出
C.除去活性炭未吸附完全的有色杂质
(4)步骤③冷却滤液时可选择__;
A.冰水浴冷却 B.搅拌下水浴冷却
C.室温下自然冷却 D.投入少量碎冰后静置
(5)步骤③中以下哪些操作不能提高产率__________;
①配制成饱和溶液后,加入过量20%的溶剂;②趁热过滤近沸溶液;③过滤Ⅰ时用少量沸水淋洗烧杯和漏斗中的固体,合并滤液;④加活性炭吸附;⑤过滤Ⅱ时的洗涤选用热水代替冷水洗涤固体.
A.①④⑤ B.①④ C.④⑤ D.②④⑤
(6)步骤③最后测得纯乙酰苯胺固体6.75g,已知苯胺、乙酸酐和乙酰苯胺的摩尔质量分别为93g/mol、102g/mol、135g/mol.该实验的产率为________(保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有m g某气体,它由双原子分子构成,它的摩尔质量为M gmol﹣1 . 若阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为;
(2)该气体所含原子总数为个;
(3)该气体在标准状况下的体积为;
(4)该气体溶于1L水中(不考虑反应),其溶液中溶质的质量分数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组数值或物理量中,都不随水的“物质的量”的变化而变化的是
A. 水的沸点;水分子的数目 B. 水的质量;水的相对分子质量
C. 水的体积;水中所含原子的数目 D. 水的密度;水的摩尔质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自来水中因含有少量 Cl-而不能用于溶液的配制,实验室为了除去自来水中的 Cl-获得纯净 水,可采用的方法是( )
A. 过滤法 B. 结晶法 C. 蒸馏法 D. 沉淀法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,水的电离达到平衡:H2OH++OH-△H>0,下列叙述正确的是( )
A. 向平衡体系中加入水,平衡正向移动,c (H+)增大
B. 将水加热,Kw增大,pH不变
C. 向水中加入少量硫酸氢钠固体,  增大
增大
D. 向水中加入少量NaOH固体,平衡正向移动,c(H+)降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Fe2O3(s)+3CO(g)2Fe(s)+3CO2(g)在不同温度下的平衡常数如表:
温度/℃ | 1000 | 1150 | 1300 |
平衡常数 | 42.9 | 50.7 | 64.0 |
请回答下列问题:
(1)该反应的平衡常数表达式K= ______ ,△H ______ 0(填“>”、“<”或“=”)。
(2)在一个容积为10L的密闭容器中,1300℃时加入Fe、Fe2O3、CO、CO2各1mol,反应经过10min后达到平衡.求该时间范围内反应的平均反应速率v(CO2)= ______ ,CO的平衡转化率为 ______。
(3)欲提高(2)中CO的平衡转化率,可采取的措施是 ______。
A.增加Fe2O3的量B.加入合适的催化剂C.移出部分CO2D.提高反应温度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列几组化合物中,属于脂质的一组是 ( )
A. 酶、胰岛素、血红蛋白 B. 核糖核酸、脂肪
C. 葡萄糖、乳酸、性激素 D. 胆固醇、性激素、维生素D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com