
【题目】25℃时,0.1molNa2CO3与盐酸混合所得的一组体积为1L的溶液,溶液中部分微粒与pH的关系如下图所示。下列有关溶液中离子浓度关系叙述正确的是
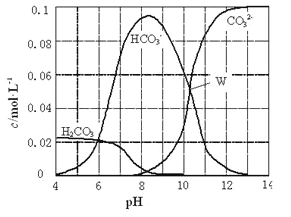
A. W点所示的溶液中:c (Na+)+c (H+)=2c(CO32-)+c (OH-)+c (Cl-)
B. pH=8的溶液中:c (H+)+c (H2CO3)+c (HCO3-)= c (OH-)+c (Cl-)
C. pH= 4的溶液中:c (H2CO3)+c (HCO3-)+c (CO32-)<0.1mol·L-1
D. pH=11的溶液中:c (Na+)>c (Cl-)>c (CO32-)>c (HCO3-)>c (H2CO3)
【答案】C
【解析】A.根据电荷守恒可知,溶液中离子应该满足关系式c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(Cl-)+c(HCO3-),故A错误;B.根据图象可知pH=8时,溶液中碳酸氢钠的浓度远远大于碳酸钠的浓度,这说明反应中恰好是生成碳酸氢钠,则根据物料守恒可知c(H2CO3)+c(HCO3-)+c(CO32-)=c(Cl-)=![]() c(Na+),则c(H+)+2c(H2CO3)+c(HCO3-)=c(OH-)+c(Cl-),故B错误;C.pH=4,说明反应中有CO2生成,所以根据物料守恒可知c(H2CO3)+c(HCO3-)+c(CO32-)<0.1 molL-1,故C正确;D.根据图象可知pH=11时,溶液碳酸钠的浓度远远大于碳酸氢钠的浓度,这说明碳酸钠是过量的,则c(Na+)>c(CO32-)>c(Cl-)>c(HCO3-)>c(H2CO3),故D错误;故选C。
c(Na+),则c(H+)+2c(H2CO3)+c(HCO3-)=c(OH-)+c(Cl-),故B错误;C.pH=4,说明反应中有CO2生成,所以根据物料守恒可知c(H2CO3)+c(HCO3-)+c(CO32-)<0.1 molL-1,故C正确;D.根据图象可知pH=11时,溶液碳酸钠的浓度远远大于碳酸氢钠的浓度,这说明碳酸钠是过量的,则c(Na+)>c(CO32-)>c(Cl-)>c(HCO3-)>c(H2CO3),故D错误;故选C。


科目:高中化学 来源: 题型:
【题目】700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g) + H2O(g)![]() CO2 (g)+ H2(g) 反应过程中不同条件下达到平衡时测定的部分数据见下表(表中t1>t2):
CO2 (g)+ H2(g) 反应过程中不同条件下达到平衡时测定的部分数据见下表(表中t1>t2):
反应时间/min | n(CO)/mol | n(H2O)/ mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
下列说不正确的是( )
A. 反应在t1min内的平均速率为v(H2)=0.40/t1 mol·L-1·min-1
B. 保持其他条件不变,起始时向容器中充入0.60 molCO和1.20 molH2O,到达平衡时,n(CO2)=0.40 mol
C. 保持其他条件不变,向平衡体系中再通入0.20 mol H2O(g),与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大
D. 温度升至800℃,上述反应平衡常数变为1.64,则正反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】链烃A是重要的有机化工原料,由A经以下反应可制备一种有机玻璃:
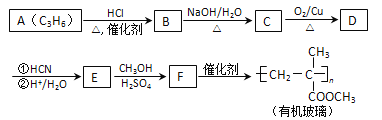
已知以下信息:
①核磁共振氢谱表明D只有一种化学环境的氢;
②羰基化合物可发生以下反应: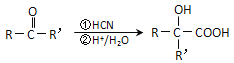 (注:R′可以是烃基,也可以是H原子)
(注:R′可以是烃基,也可以是H原子)
③E在甲醇、硫酸的作用下,发生酯化、脱水反应生成F。
回答下列问题:
(1)A的结构简式为_____,A生成B的反应类型为_______。
(2)B生成C的化学方程式为_______。
(3)D的结构简式为_____,分子中最多有 __________个原子共平面。
(4)F的化学名称为_______。
(5)F的同分异构体中能同时满足下列条件的共有 ______种(不含立体异构);其中核磁共振氢谱显示为4组峰,且峰面积比为3 : 2 : 2 : 1的是_____; (写出其中一种的结构简式)。
①能与饱和NaHCO3溶液反应产生气体 ②能使Br2的四氯化碳溶液褪色
(6)聚乳酸(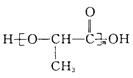 )是一种生物可降解材料,参考上述信息设计由乙醇制备聚乳酸的合成路线 ___________ 。合成路线流程图图示例如下:
)是一种生物可降解材料,参考上述信息设计由乙醇制备聚乳酸的合成路线 ___________ 。合成路线流程图图示例如下:
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇燃料电池体积小、洁净环保、理论能量比高,已在便携式通讯设备、汽车等领域应用。某甲醇燃料电池的总反应式2CH4O + 3O2= 2CO2+ 4H2O,下图是该燃料电池的示意图。下列说法正确的是

A. a是甲醇燃料、b是氧气
B. 当转移6mole-时,消耗33.6LO2
C. 负极反应:CH4O - 6e-+ H2O = CO2↑+ 6H+
D. 质子从N电极区穿过交换膜移向M电极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于容量瓶的四种叙述:①是配制准确浓度溶液的仪器;②不宜贮存溶液;③不能用来加热;④使用之前要检查是否漏水.这些叙述中正确的是( )
A.①②③④
B.②③
C.①②④
D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏伽德罗常数的数值,下列说法正确的是
A. 常温下7.2gCaO2晶体中阴离子和阳离子总数为0.3NA
B. 1mol/L的氯化铁溶液中,若CI-的数目为3NA,则Fe3+的数目为NA
C. 反应3H2(g)+N2(g)2NH3(g) ΔH=-92KJ/mol,当放出热量9.2KJ时,转移电子0.6NA
D. 标准状况下,11.2L三氯甲烷中含有含极性共价键数目为1.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,某容积固定的密闭容器中,建立下列化学平衡:C(s)+H2O(g)![]() CO(g)
CO(g)
+H2(g)。下列叙述中不能说明上述可逆反应已达到化学平衡状态的是( )
A. 体系的压强不再发生变化
B. v正(CO)=v逆(H2O)
C. 生成n mol CO的同时生成n mol H2
D. 1 mol H—H键断裂的同时断裂2 mol H—O键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种以NaBH4和H2O2为原料的新型电池的工作原理如图所示。下列说法错误的是( )

A. 电池的负极反应为BH4--8e-+8OH-=BO2-+6H2O
B. 电池放电时Na+从b极区移向a极区
C. 电子从电极a经外电路流向电极b
D. 放电一段时间后,正负两极生成的OH-和消耗的OH-的量相等。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.硫酸亚锡(SnSO4)是一种重要的能溶于水的硫酸盐,广泛应用于镀锡工业。某研究小组设计SnSO4制备路线如下:
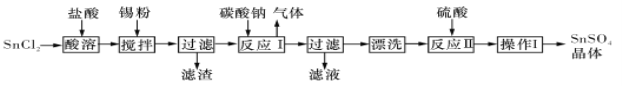
查阅资料:
A.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
B.SnC12易水解生成碱式氯化亚锡
回答下列问题:
(1)SnCl2粉末需加浓盐酸进行溶解,请结合必要的化学方程式用平衡移动原理解释原因:___________。
(2)加入Sn粉的作用有两个:①调节溶液pH;②__________。
(3)反应I得到沉淀SnO,得到该沉淀的离子反应方程式是____________。
(4)操作I是____________。
II.已知25℃时,AgI饱和溶液中c(Ag+)为1.22×10-8 mol/L,AgCl的饱和溶液中c(Ag+)为1.25×10-5 mol/L。若在10 mL含有KCl和KI各为0.01 mol/L的溶液中,加入16 mL 0.01 mol/L AgNO3溶液,这时溶液中所含溶质的离子浓度大小关系正确的是
c(K+)>c(NO![]() )>c(Cl-)>c(Ag+)>c(I-)
)>c(Cl-)>c(Ag+)>c(I-)
B .c(K+)>c(NO![]() )>c(Ag+)>c(Cl-)>c(I-)
)>c(Ag+)>c(Cl-)>c(I-)
C.c(K+)>c(NO![]() )>c(Ag+)=c(Cl-)+c(I-)
)>c(Ag+)=c(Cl-)+c(I-)
D.c(NO![]() )>c(K+)>c(Ag+)>c(Cl-)>c(I-)
)>c(K+)>c(Ag+)>c(Cl-)>c(I-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com