
����Ŀ����֪K��Ka��Kw��Ksp�ֱ��ʾ��ѧƽ�ⳣ��������ĵ���ƽ�ⳣ����ˮ�����ӻ����������ܵ���ʵ��ܶȻ�������
��1���й�����������˵����ȷ����___��
![]() ���Ƕ��ܷ�ӳһ�������¶�Ӧ�仯���еij̶�
���Ƕ��ܷ�ӳһ�������¶�Ӧ�仯���еij̶�
![]() ���ǵĴ�С�����¶ȵ����߶�����
���ǵĴ�С�����¶ȵ����߶�����
![]() �����£�CH3COOH��ˮ�е�Ka�����ڱ���CH3COONa��Һ�е�Ka
�����£�CH3COOH��ˮ�е�Ka�����ڱ���CH3COONa��Һ�е�Ka
��2����֪25��ʱCH3COOH��NH3��H2O���볣����ȣ�����¶���CH3COONH4��Һ��ˮ�����H+Ũ��Ϊ___����Һ������Ũ�ȴ�С��ϵΪ___��
��3���Ȼ�����Һ���ɡ����պ�õ��Ĺ���������___��
��4����ĭ������ķ�Ӧԭ��(��������Һ��С�մ�)___��(д���ӷ���ʽ)
��5����֪��25��ʱKsp[Mg(OH)2]=3.2��10-11��Ksp[Cu(OH)2]=2.2��10-20��25��ʱ����Ũ�Ⱦ�Ϊ0.02mol��L-1��MgCl2��CuCl2�����Һ����μ���NaOH��Һ�������ɳ���___(�ѧʽ)�������ֳ�������ʱ��![]() =___��
=___��
���𰸡�a 1.0��10-7mol/L c(NH4+)=c(CH3COO-)��c(OH-)=c(H+) Al2O3 Al3++3HCO3-=Al(OH)3��+3CO2�� Cu(OH)2 1.45��109
��������
(1)ƽ�ⳣ��ֻ���¶��йأ���������¶ȣ�ƽ�������ȷ����ƶ������жϣ�
(2)CH3COOH��NH3��H2O���볣����ȣ�����¶���CH3COONH4��Һ笠����Ӻʹ��������ˮ��̶���ͬ�����´������Һ�����ԣ�ˮ�ĵ���̶Ⱥ�С���ݴ��ж�����Ũ�ȴ�С��
(3)�Ȼ�����Һ��������ˮ�������������������ᣬ��Һ�����ԣ�ˮ�����Ϊ���ȷ�Ӧ�����ȴٽ�ˮ�⣬���ɵõ�ˮ��������ʱ���ɵ����������ֽ�������������
(4)��ĭ�����װ��̼��������Һ����������Һ����˫ˮ���������������Ͷ�����̼��
(5)�ܶȻ�����С���Ȳ��������������ֳ�������ʱ�� ��
�� �������
�������
(1)a��ƽ�ⳣ������������Ũ����֮���뷴Ӧ��Ũ����֮���ıȣ��������Ƕ��ܷ�ӳһ�������¶�Ӧ�仯���еij̶ȣ���a��ȷ��b�������¶�ƽ�������ȷ����ƶ������ij��ѧ��Ӧ������Ӧ�Ƿ��ȷ�Ӧ���������¶Ȼ�ѧƽ�ⳣ������С����b����c������ƽ�ⳣ��ֻ���¶��йأ��¶���ͬ������ƽ�ⳣ����ͬ����c����ѡa��
(2)CH3COOH��NH3��H2O���볣����ȣ�����¶���CH3COONH4��Һ笠����Ӻʹ��������ˮ��̶���ͬ�����´������Һ�����ԣ�ˮ�������������Ũ��Ϊ1.0��10-7mol/L��ˮ�ĵ���̶Ⱥ�С����Һ������Ũ�ȴ�С˳��Ϊc(NH4+)�Tc(CH3COO-)��c(OH-)�Tc(H+)���ʴ�Ϊ��1.0��10-7mol/L��c(NH4+)�Tc(CH3COO-)��c(OH-)�Tc(H+)��
(3)�Ȼ�����Һ��������ˮ�������������������ᣬ��Һ�����ԣ�AlCl3+3H2OAl(OH)3+3HCl��ˮ�����Ϊ���ȷ�Ӧ�����ȴٽ�ˮ�⣬����ʱ��HCl�ӷ����ٽ�ˮ��������У��õ�ˮ�����Al(OH)3������ʱ���ɵ����������ֽ�������������2Al(OH)3 ![]() Al2O3+3H2O�����ʴ�Ϊ��Al2O3��
Al2O3+3H2O�����ʴ�Ϊ��Al2O3��
(4)��ĭ�����װ��̼��������Һ����������Һ��̼����������ǿ�������ε���ʽ�Σ�����������ǿ�������Σ����߷���˫ˮ�ⷴӦ��������ĭ������ķ�Ӧԭ��Ϊ��Al3++3HCO3-=Al(OH)3��+3CO2�����ʴ�Ϊ��Al3++3HCO3-=Al(OH)3��+3CO2����
(5)�ܶȻ�����ԽС��Խ�Ȳ������������������ɳ�������Cu(OH)2�������ֳ�������ʱ�� ��
�� =
= =
=![]() =1.45��109���ʴ�Ϊ��Cu(OH)2��1.45��109��
=1.45��109���ʴ�Ϊ��Cu(OH)2��1.45��109��


 �������ͬ������ϵ�д�
�������ͬ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�����ظ�����(Na2Cr2O7)�ᾧ���ĸҺ(����������Fe3+)�����ظ����(K2Cr2O7)���������̼���������ܽ��������ͼ��


(1)��Na2Cr2O7����K2Cr2O7�Ļ�ѧ����ʽΪ________________��
(2)��ͼ����ѡ����ȴ�ᾧ��ԭ����_______________��
(3)��Na2Cr2O7ĸҺ�мӼ�Һ��pH��Ŀ����_____________��
(4)����õ�����A�ķ�ʽΪ______������ˮϴ�ӹ���A�����յ�ϴ��Һת�Ƶ�ĸҺ____(����������������������)�У�������߲����ֿ�ʹ�ܺ���͡�
(5)���������к�Cr2O72-�ķ�ˮ�����ڴ�����ˮ�е�CN-���������̰���ͼ���̽���:
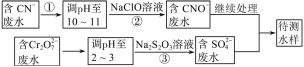
������У�ÿ����0.3 mol Cr2O72-ʱת�Ƶ���1.8 mol���÷�Ӧ�����ӷ���ʽΪ________��
�ڴ�������Cr2O72-��ˮ������������巨���÷������ˮ�м���FeSO4��7H2O��Cr2O72-��ԭ��Cr3+������pH��Fe��Crת�����൱��Fe��[FexIIICr(2-x)III]O4 (�������壬�������ֱ�ʾԪ�ؼ�̬)�ij���������1 mol Cr2O72-�������a mol FeSO4��7H2O�����н�����ȷ����_______��
A.x=0.5��a=6 B.x=0.5��a=10
C.x=1.5��a=6 D.x=1.5��a=10
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����к͵ζ����ⶨ�ռ�Ĵ��ȣ����ռ��в��������ᷴӦ�����ʣ��Ը���ʵ��ش�
(1)ȷ��ȡ4.1 g�ռ���Ʒ��
(2)����Ʒ���250 mL����Һ����Ҫ����������С�ձ�������������Ͳ����Ҫ____��____��
(3)ȡ10.00 mL����Һ����____��ȡ��
(4)��0.2010 mol��L-1������ζ������ռ���Һ��������ָʾ�����ζ�ʱ������ת�ζ��ܵIJ������������ֲ�ͣ��ҡ����ƿ,����ע��____��������_______������ʱ������ζ��յ㡣
(5)�����������ݣ���������ռ�Ĵ���:____��(������λ��Ч����)
�ζ����� | ����Һ���(mL) | ���������(mL) | |
�ζ�ǰ����(mL) | �ζ������(mL) | ||
��һ�� | 10.00 | 0.50 | 20.40 |
�ڶ��� | 10.00 | 0.10 | 22.10 |
������ | 10.00 | 4.00 | 24.10 |
(6)���²�������ɲ������ƫ�ߵ���_______(�����)��
��������ˮ��ϴ��ƿ
���ڵζ������в�����������Һ������ƿ��
�۶���ʱ,�ζ�ǰ����,�ζ�����
��װ��Һ֮ǰ,û���ñ�Һ��ϴ�ζ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧʽΪC5H7Cl���л����ṹ�������ǣ� ��
A.ֻ��1��![]() ����ֱ���л���
����ֱ���л���
B.��2��![]() ����ֱ���л���
����ֱ���л���
C.��1��![]() ���Ļ�״�л���
���Ļ�״�л���
D.��1����C![]() C������ֱ���л���
C������ֱ���л���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ���������������أ�����˵����ȷ���ǣ� ��
A.����������Ƕп�����������Է����屻��ʴ
B.����β����NO��CO���Ի�����Ӧ����N2��CO2����Сѹǿ����Ӧ���ʼ���
C.����ұ�������ǽ������ӵõ��ӱ�ɽ������ʵ���������
D.PM2.5����![]() ��ֱ��ԼΪ2.5��106m)��ɢ�ڿ������γ����ܽ�
��ֱ��ԼΪ2.5��106m)��ɢ�ڿ������γ����ܽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��ijͬѧ���һ��ȼ�ϵ�ز�̽���ȼҵԭ���͵��CuSO4��Һ��������װ����XΪ�����ӽ���Ĥ��
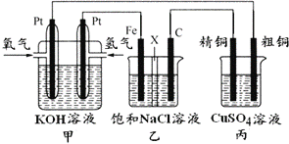
����Ҫ��ش�������⣺
��1��ͨ�������ĵ缫Ϊ___(��������������������)�������ĵ缫��ӦʽΪ___��
��2�����缫Ϊ___(��������������������)��ʯī�缫��C���ĵ缫��ӦʽΪ___��
��3����װ���е����ܷ�Ӧ�����ӷ���ʽΪ___��
��4�����ڱ�״���£���1.12L�����μӷ�Ӧ����װ�����������ص�����Ϊ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������в���ȷ����
A.NH3������H����ϵĹ����У�Nԭ�ӵ��ӻ�����δ�����ı�
B.ij�����̬�����磬����״̬�ܵ��磬���Խϳ��˵���þ��������Ӿ���
C.���־���ͷǾ�����ɿ��Ŀ�ѧ�����ǶԹ������X����������ʵ��
D.��̬SO3��SO2����ԭ�ӵŵ��Ӷ���Ŀ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����顢��ϩ�������Ҵ�����������������������������г��õ��л���ش������й����⣺
��1��CH4��Cl2�ڹ��������·�Ӧ����CH3Cl��CH2Cl2��CHCl3��CCl4���л����Щ��Ӧ���л���Ӧ������___��
��2��CH2=CH2�ܹ�ʹ��ˮ��ɫ����д���÷�Ӧ�Ļ�ѧ����ʽ___��������CH2=CH2ͨ���������Ը��������Һ�ķ�Ӧ������___��
��3���ñ���ȡ��ˮ�еⵥ�������õķ��뷽����___��
��4��д���������������ŵ�����___��
��5��д��������Ҵ���Ũ�����������������������Ļ�ѧ��Ӧ����ʽ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Ǵ�ͳ�в�ҩ���˵���Ч�ɷ�֮һ��������ϸ����ɱ���ж������á������� �غ������ص�������ȷ����
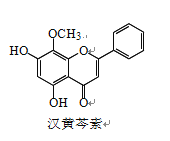
A. �������صķ���ʽΪ C16H13O5
B. �������� FeCl3 ��Һ��ɫ
C. 1 mol ����������ˮ��Ӧ��������� 1 mol Br2
D. ������ H2 �����ӳɷ�Ӧ�÷����й����ŵ�������� 1 ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com