
| A. | 500mL 0.5mol•L-1 K2SO4溶液中,K+的总数为NA | |
| B. | 2L 0.5mol•L-1 K2SO4溶液中阴离子所带电荷数为NA | |
| C. | 18g H2O中含有10NA个质子 | |
| D. | 2L水中溶有80g的氢氧化钠,溶液的物质的量浓度为2mol•L-1 |
分析 A.硫酸钾溶液中完全电离,离子物质的量=溶质物质的量×离子数;
B.n=cV,计算硫酸根离子物质的量,硫酸根离子带2个负电荷,水溶液中氢氧根离子带一个负电荷;
C.一个水分子中含10个质子,n=$\frac{m}{M}$计算分析;
D.溶质物质的量n=$\frac{m}{M}$,溶液体积不是2L;
解答 解:A.500mL 0.5mol•L-1 K2SO4溶液中,K+的总数=0.5L×0.5mol/L×2×NA=0.5NA,故A错误;
B.2L 0.5mol•L-1 K2SO4溶液中,硫酸根离子物质的量=2L×0.5mol/L=1mol,硫酸根离子带2个负电荷,水溶液中氢氧根离子带一个负电荷,阴离子所带电荷数大于2NA,故B错误;
C.18g H2O物质的量=$\frac{18g}{18g/mol}$=1mol,一个水分子中含10个质子,含有10NA个质子,故C正确;
D.2L水中溶有80g的氢氧化钠,溶质物质的量=$\frac{80g}{40g/mol}$=2mol,溶液体积大于2L,则溶液的物质的量浓度小于2mol•L-1,故D错误;
故选C.
点评 本题考查了阿伏伽德罗常数的分析应用,主要是微粒数和物质的量的计算关系、溶液浓度和微粒结构的理解应用,掌握基础是解题关键,题目难度不大.


 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 苯中的甲苯(溴水) | B. | 溴苯中的溴(苯) | ||
| C. | 乙烷中的乙烯(酸性高锰酸钾) | D. | 95.6%乙醇中的水(CaO) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
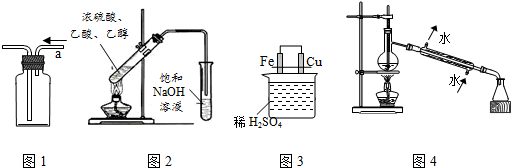
| A. | 用图1所示装置从a口进气可收集CH2=CH2 | |
| B. | 用图2所示装置制取并收集乙酸乙酯 | |
| C. | 用图3所示装置比较Fe、Cu的金属活动性 | |
| D. | 用图4所示装置进行石油的蒸馏实验 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,5.6L CO2与足量Na2O2反应转移的电子数为0.5NA | |
| B. | Na2O由两种单质直接反应生成,将其加入Ba(HCO3)2溶液中同时有气体和沉淀产生 | |
| C. | Na2O2与水反应是水作还原剂的氧化还原反应 | |
| D. | 二氧化碳通过Na2O2粉末,反应后固体物质增重 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,14g CO和N2的混合物含的原子数为NA | |
| B. | 1mol Fe发生氧化反应失去的电子数一定是3NA | |
| C. | 0.1mol•L-1 NaCl溶液中含的Cl-数是0.1NA | |
| D. | 0.1mol H2SO4与1L 0.1mol•L-1 NaOH溶液反应,生成的H2O分子数是0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com