
| T/℃ | 活性氧百分含量 | 产率 |
| 5~10 | 13.94 | 85.49 |
| 10~15 | 14.02 | 85.78 |
| 15~20 | 15.05 | 88.38 |
| 20~25 | 14.46 | 83.01 |
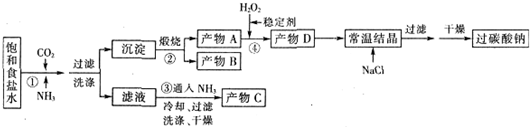
分析 氨气易溶于水,与二氧化碳、氯化钠溶液反应生成碳酸氢钠和氯化铵,反应方程式为NaCl+CO2+NH3+H2O═NH4Cl+NaHCO3↓;过滤得到滤液和沉淀,沉淀为NaHCO3,加热碳酸氢钠分解生成碳酸钠(A)、水和二氧化碳,碳酸钠与双氧水反应生成过碳酸钠,然后向溶液中加入氯化钠固体、常温结晶、过滤、干燥得到过碳酸钠;
(1)过碳酸钠具有碳酸钠和过氧化氢的性质,能与比碳酸强的酸反应、能发生分解反应、能被强氧化剂氧化;
(2)氨气易溶于水,二氧化碳溶解性较氨气弱,应该先通入溶解性大的气体;
(3)加入NaCl能降低过碳酸钠溶解度;
(4)碳酸氢钠分解生成碳酸钠、水和二氧化碳;
(5)从溶液中过滤出固体后,需要洗涤沉淀;
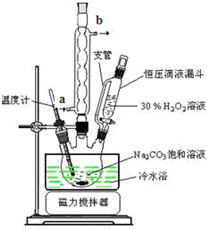
(6)恒压滴液漏斗能保持压强恒定;
冷凝管内水采用逆流方法;
(7)根据表数据可知温度超过20℃后,活性氧百分含量和产率均降低.
解答 解:氨气易溶于水,与二氧化碳、氯化钠溶液反应生成碳酸氢钠和氯化铵,反应方程式为NaCl+CO2+NH3+H2O═NH4Cl+NaHCO3↓;过滤得到滤液和沉淀,沉淀为NaHCO3,加热碳酸氢钠分解生成碳酸钠(A)、水和二氧化碳,碳酸钠与双氧水反应生成过碳酸钠,然后向溶液中加入氯化钠固体、常温结晶、过滤、干燥得到过碳酸钠;
(1)过碳酸钠具有碳酸钠和过氧化氢的性质,能与比碳酸强的酸反应、能发生分解反应、能被强氧化剂氧化,
A.FeCl3溶液具有氧化性,能氧化双氧水而导致过碳酸钠失效,故A正确;
B.H2S具有还原性,能将双氧水还原而使过碳酸钠失效,故B正确;
C.稀硫酸酸性大于碳酸,所以稀硫酸和碳酸钠反应而失效,故C正确;
D.NaHCO3溶液和碳酸钠、双氧水都不反应,所以不能使过碳酸钠失效,故D错误;
故选ABC;
(2)氨气易溶于水,二氧化碳溶解性较氨气弱,应该先通入溶解性大的气体,所以应该先通入氨气,反应方程式为NaCl+CO2+NH3+H2O═NH4Cl+NaHCO3↓,
故答案为:氨气;NaCl+CO2+NH3+H2O═NH4Cl+NaHCO3↓;
(3)加入NaCl能降低过碳酸钠溶解度而析出更多的过碳酸钠,
故答案为:降低2 Na2CO3•3H2O2的溶解度,析出更多晶体;
(4)反应①中二氧化碳参加反应、②中生成二氧化碳,所以能循环利用的物质是CO2,故答案为:CO2;
(5)从溶液中过滤出固体后,需要洗涤沉淀,其操作方法是沿玻璃棒向漏斗(过滤器)中的沉淀上加蒸馏水至淹没沉淀,静置使其全部滤出,重复操作2-3次,
故答案为:晶体的洗涤;沿玻璃棒向漏斗(过滤器)中的沉淀上加蒸馏水至淹没沉淀,静置使其全部滤出,重复操作2-3次;
(6)恒压滴液漏斗能保持压强恒定,因此恒压滴液漏斗中支管的作用是使液体顺利流下.冷凝管应从下端进水,即a处进水上端出水,故答案为:使液体顺利流下;a;
(7)根据表数据可知温度超过20℃后,活性氧百分含量和产率均降低,所以反应最佳的温度选择的范围是15~20℃,故答案为:15~20℃.
点评 本题考查物质制备,为高频考点,涉及数据分析、实验操作、氧化还原反应等知识点,明确元素化合物性质及其性质差异性、实验操作规范性等是解本题关键,注意实验操作规范性,题目难度中等.


科目:高中化学 来源: 题型:解答题
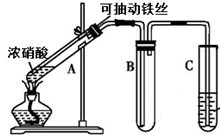 某校化学兴趣小组利用如图所示装置进行探究铁与浓硝酸的反应.
某校化学兴趣小组利用如图所示装置进行探究铁与浓硝酸的反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
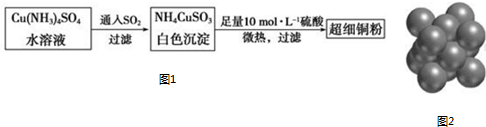
 ; NH4CuSO3中N、O、S三种元素的第一电离能由大到小顺序为N>O>S(填元素符号).
; NH4CuSO3中N、O、S三种元素的第一电离能由大到小顺序为N>O>S(填元素符号).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
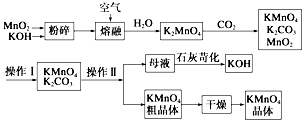
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
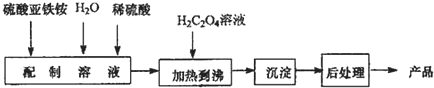
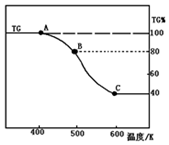
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 编号 | 0.1mol/L H2C2O4 溶液的体积/mL | 0.01mol/L 酸性 KMnO4 的体积/mL | 蒸馏水的体积/mL | 温度/℃ |
| ① | 2 | 4 | 2 | 25 |
| ② | 3 | |||
| ③ | 50 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com