
【题目】25℃时,改变醋酸溶液的pH[溶液中c(CH3COOˉ)与c(CH3COOH)之和始终为0.1mol·Lˉ1],溶液中H+、OHˉ、CH3COOˉ及CH3COOH浓度的对数值(lgc)与pH关系如图所示。

下列说法错误的是
A. lgK(CH3COOH)=-9.26
B. 图中①表示 CH3COOH浓度的对数值与pH的关系曲线
C. 0.1mol·Lˉ1CH3COOH溶液的pH约为2.88
D. 0.1mol·Lˉ1CH3 COONa溶液的pH约为8.87
【答案】A
【解析】
醋酸溶液中存在CH3COOHCH3COO-+H+的电离平衡,c(CH3COOH)+c(CH3COO-)=0.1molL-1,在强酸性溶液中c(CH3COOH)≈0.1mol/L,lgc(CH3COOH)≈-1,强碱性溶液中c(CH3COO-)≈0.1mol/L,lgc(CH3COO-)≈-1,根据图知,①为表示CH3COOH的曲线、②为表示CH3COO-的曲线,酸性越强lg(H+)越大、lg(OH-)越小,碱性越强lg(H+)越小、lg(OH-)越大,所以③线是表示H+的曲线、④线是表示OH-的曲线,据此分析解答。
A.K(CH3COOH)=![]() ,当c(CH3COOH)=c(CH3COO-),Ka=c(H+)=10-4.75,lgK(CH3COOH)=-4.75,故A错误;
,当c(CH3COOH)=c(CH3COO-),Ka=c(H+)=10-4.75,lgK(CH3COOH)=-4.75,故A错误;
B.根据上述分析,①为表示CH3COOH的曲线、②为表示CH3COO-的曲线,③线是表示H+的曲线、④线是表示OH-的曲线,故B正确;
C. 醋酸为弱酸,电离程度较小,因此0.1mol·Lˉ1CH3COOH溶液中c(CH3COO-)≈c(H+),根据图知,这两种微粒浓度相等的点对应的pH约为2.88,故C正确;
D.因为醋酸钠水解程度较小,所以醋酸钠溶液中c(CH3COOH)≈c(OH-),根据图知,这两种微粒浓度相等的点对应的pH=8.87,故D正确;故选A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】如图为元素周期表的一部分,请参照①-⑨在表中的位置,回答下列问题:(用元素符号或化学用语回答)

(1)由①②⑧三种元素形成的常见化合物的电子式为_____,其包含的化学键类型为_____(填“离子键”、“共价键”)。
(2)⑦和⑨能以原子个数1:2形成化合物,用电子式表示其形成过程______________。
(3)金属性最强是____________。
(4)③的简单氢化物的沸点比⑦的简单氢化物的沸点___(填“高”或“低”),理由_____________。
(5)元素⑥的单质和④的最高价氧化物的水化物之间发生反应的离子方程式为:____________。
(6)在②的化合物中,红棕色、有刺激性气味的有毒气体是___________(填写化学式),请写出该气体与水反应的化学方程式________________________。
(7)⑦的最高价氧化物对应水化物的浓溶液在加热时与碳发生反应的化学方程式为:_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.羰基硫(COS)广泛存在于以煤为原料的各种化工原料气中,能引起催化剂中毒、化学产品质量下降和大气污染,研究其脱除方式意义重大。回答下列问题:
(1)COS 的分子结构与 CO2 相似,COS 的电子式为_____。
(2)已知:① CO(g)+H2O(g) ![]() H2(g)+CO2(g) ΔH1=-41.2 kJ·mol-1
H2(g)+CO2(g) ΔH1=-41.2 kJ·mol-1
② COS(g)+H2O(g) ![]() H2S(g)+CO2(g) ΔH2=-35.5 kJ·mol-1
H2S(g)+CO2(g) ΔH2=-35.5 kJ·mol-1
则氢气脱除 COS 生成 CO 和 H2S 的热化学方程式为________________________________。
II. 通常人们把拆开 1 mol 某化学键所吸收的能量看成该化学键的键能。键能的大小可用于估算化学反应的反应热(△H),化学反应的△H 等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。工业上高纯硅可通过下列反应制取:
SiCl4(g) + 2H2(g) = Si(s) + 4HCl(g) △H = + 236 kJ/mol
键能 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
(kJ·mol-1) | 460 | 360 | 436 | 431 | x | 347 |
表中 x=_____。
Ⅲ. “绿水青山就是金山银山”,利用原电池原理(6NO2 +8NH3 = 7N2+12H2O)可以处理氮的氧化物和NH3 尾气,装置原理图如图:

负极反应式为____________, 标准状况下有 4.48 L NO2 被处理时,转移电子的物质的量为_______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 117g苯含有C=C双键的物质的量为4.5mol
B. 浓度均为0.1mol/L的CH3COOH和CH3COONa溶液等体积混合 c(CH3COO-)+ c(CH3COOH)=2c(Na+)
C. 1molCl2与足量的NaOH溶液反应,转移电子的物质的量为2 mol
D. Ksp(BaSO4)=1.07×10-10,Ksp(BaCO3)=2.58×10-9,所以任何条件都不能将BaSO4转化为BaCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于溶液的酸碱性说法正确的是( )
A.水电离的 c(H+)=1×10﹣13 molL﹣1一定呈碱性B.pH=7的溶液一定呈中性
C.c(OH﹣)=c(H+)的溶液一定呈中性D.不能使酚酞试液变红的溶液一定呈酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组同学利用以下装置制备氨气,并探究氨气的性质(部分仪器已略去)。请回答下列问题:
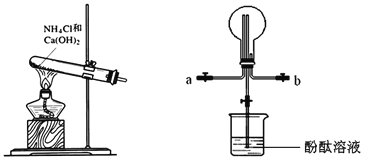
A B
(1)实验室制备氨气的化学方程式为______;干燥氨气常用的干燥剂是_____。
(2)收集氨气时,请你选择氨气的进气口_________(填“a”或“b”)。
(3)①、若观察到装置B中的烧瓶内产生了红色喷泉,则说明氨气具有的性质是_____。
②、若装置B中的烧瓶充满干燥气体,烧杯中盛有液体,下列组合中不可能形成喷泉的是___
A HCl和H2O B H2和H2O C CO2和NaOH
(4)氨气在催化剂并且加热时会被空气氧化,这是工业制硝酸的第一步反应,写出该反应的化学方程式__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有五种短周期主族元素 X、 Y、 Z、 M、 Q, 它们的原子序数逐渐增大; 在周期表中的位置如图所示, M 的电子层数与主族序数相等。 下列说法错误的是
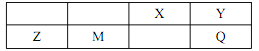
A. 工业上用电解熔融的 Z 的氯化物制 Z
B. Y 和 Q 的最简单氢化物熔点: Y<Q
C. Z、 M、 Y 的简单离子半径: Y>Z>M
D. X 和 Y 的最简单氢化物的稳定性: X<Y
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com