
【题目】短周期元素X、Y、Z、Q、T的原子序数与其常见化合价关系如图所示。下列说法正确的是( )
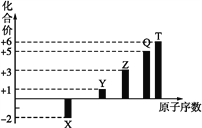
A. 1 mol TX2与足量X2反应生成TX3的分子数目为NA
B. Z元素形成的可溶性盐溶液可能显碱性
C. 1 mol Y2X2与足量H2O反应转移的电子数目为2NA
D. 0.1 mol Q元素的含氧酸在水中电离出的H+数目为3NA
【答案】B
【解析】由图中化合价可知,X的化合价为-2价,没有正化合价,故X为O元素,Y的化合价为+1价,处于ⅠA族,原子序数大于O元素,故Y为Na元素,Z为+3价,为Al元素,Q的化合价为+5价,故Q为P元素,T的最高正价为+6价,应为S元素;A.1molSO2与O2反应为可逆反应,1molSO2与足量O2反应生成SO3的分子数目小于NA,故A错误;B.Al元素形成的可溶性盐如NaAlO2在溶液中显碱性,故B正确;C.Na2O2与H2O的反应2Na2O2+2H2O=4NaOH+O2↑,反应中2molNa2O2转移2mol电子,则1mol Na2O2与足量H2O反应转移的电子数目为NA,故C错误;D.P的含氧酸H3PO4为中强酸,在溶液中部分电离,所以0.1molP元素的含氧酸在水中电离出的H+数目为小于0.3NA,故D错误;故答案为B。


科目:高中化学 来源: 题型:
【题目】二甲醚(CH3OCH3)是一种清洁、高效、具有优良的环保性能的可燃物,被称为21世纪的新型能。工业制备二甲醚的生产流程如下:
催化反应室中(压力2.0~10.0MPa,温度300℃)进行下列反应:
(Ⅰ)CO(g)+2H2(g) ![]() CH3OH(g) ΔH1=-90.7kJ·mol-1
CH3OH(g) ΔH1=-90.7kJ·mol-1
(Ⅱ)2CH3OH(g) ![]() CH3OCH3(g)+H2O(g) ΔH2=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH2=-23.5kJ·mol-1
(Ⅲ)CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH3=-41.2kJ·mol-1
CO2(g)+H2(g) ΔH3=-41.2kJ·mol-1
(1)催化反应室中的总反应:3CO(g)+3H2(g) ![]() CH3OCH3(g)+CO2(g)
CH3OCH3(g)+CO2(g)
①该反应的反应热△H=__________。
②催化反应室中采用300℃的反应温度,理由是______________________________。
(2)已知:反应(Ⅰ)在300℃时的化学平衡常数为0.27。该温度下将2molCO、3molH2和2molCH3OH充入容积为2L的密闭容器中,此时反应将__________(填“正向进行”、“逆向进行”或“处于平衡状态”)。
(3)上述流程中二甲醚精制的实验操作名称为____________________。
(4)如图为绿色电“二甲醚燃料电池”的工作原理示意图。
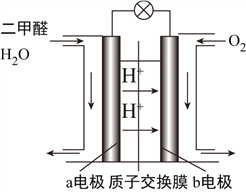
①该电池工作时,H+向__________极移动(填“正”或“负”);
②a电极的电极反应式为________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 增进健康应以平衡膳食为主,保健食品为辅
B. 膳食中的钙与磷、蛋白质配合,容易被人体吸收
C. 多晒太阳有利于钙的吸收
D. 钙、铁同补相得益彰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素R的最高价含氧酸的化学式为HnRO2n-2 ,则在气态氢化物中R元素的化合价为( )
A. 12-3n B. 3n-12 C. 3n-10 D. 6-3n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据盖斯定律计算:已知金刚石和石墨分别在氧气中完全燃烧的热化学方程式为C(金刚石,s)+O2(g)===CO2(g) ΔH1=-395.41 kJ/mol,C(石墨,s)+O2(g)===CO2(g) ΔH2=-393.51 kJ/mol,则金刚石转化为石墨时的热化学方程式为________________________________________________________________________。
由此看来更稳定的碳的同素异形体为________。
若取金刚石和石墨的混合晶体共1 mol在O2中完全燃烧,产生热量为Q kJ,则金刚石和石墨的物质的量之比为__________________(用含Q的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去某物质中所含的杂质,所选用的试剂或操作方法正确的是( )
序号 | 物质 | 杂质 | 除杂质应选用的试剂或操作方法 |
① | KNO3溶液 | KOH | 滴入稀HNO3同时用pH计测定至溶液呈中性 |
② | FeSO4溶液 | CuSO4 | 加入过量铁粉并过滤 |
③ | H2 | CO2 | 依次通过盛有NaOH溶液和浓硫酸的洗气瓶 |
④ | NaNO3 | CaCO3 | 加稀盐酸溶解、过滤、蒸发、结晶 |
A.①②③ B.②③④ C.①③④ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示3套实验装置,分别回答下列问题。
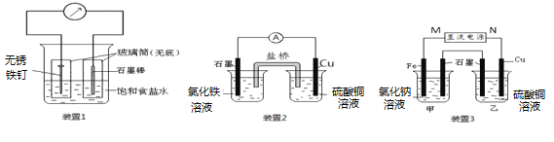
(1)装置1为铁的吸氧腐蚀实验。一段时间后,向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为_________________。
(2)装置2中的石墨是极________(填“正”或“负”),该装置发生的总反应的离子方程式为________________________。
(3)装置3中甲烧杯盛放100 mL 0.2 mol/L的NaCl溶液,乙烧杯盛放100 mL 0.5 mol/L的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞溶液,观察到石墨电极附近首先变红。
① 电源的M端为极____________(填“正”或“负”),甲烧杯中铁电极的电极反应为__________。
② 乙烧杯中电解反应的化学方程式为___________________________。
③ 停止电解,取出Cu电极,洗涤、干燥、称量、电极增重 0.64 g,甲烧杯中产生的气体标准状况下体积为___________mL。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com