
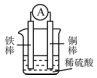
| A. | 铜棒逐渐溶解,溶液由无色慢慢地变为黄色 | |
| B. | 铁棒为负极,电子从铁棒经外电路流向铜棒 | |
| C. | 电池工作一段时间后,溶液的酸性将增强 | |
| D. | 该电池的总反应为Fe2++Cu═Fe+Cu2+ |
分析 由图中的铜铁原电池可知,Fe活泼,则Fe作负极,Cu作正极,发生电池反应为Fe+H2SO4═FeSO4+H2↑,电子由负极流向正极,以此来解答.
解答 解:A、由铜铁原电池可知,Fe活泼,则Fe作负极,Cu作正极,铜棒上氢离子得电子放出氢气,故A错误;
B、Fe作负极,Cu作正极,则电子从铁棒经外电路流向铜棒,故B正确;
C、由发生电池反应为Fe+H2SO4═FeSO4+H2↑,则电池工作一段时间后,溶液的酸性将减弱,故C错误;
D、该电池的总反应为Fe+H2SO4═FeSO4+H2↑,故D错误;
故选B.
点评 本题考查原电池的工作原理,明确电极的判断、电极反应、电池反应等即可解答,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | H2SO3的电离方程式:H2SO3?2H++SO${\;}_{3}^{2-}$ | |
| B. | Cl-的结构示意图: | |
| C. | 乙醇的结构式:C2H5OH | |
| D. | HOCH2COOH缩聚产物的结构简式: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ①②④⑤ | C. | ①②③④ | D. | ②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.0 g H218O与D2O的混合物中所含中子数为NA | |
| B. | 2.8gN2和CO的混合气体中所含质子数为1.4NA | |
| C. | 过氧化钠与水反应时,生成0.1 mol氧气转移的电子数为0.2NA | |
| D. | 50mL12mol/L-1盐酸与足量MnO2共热,转移的电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 人类目前所直接利用的能量大部分是由化学反应产生的 | |
| B. | 人体运动所消耗的能量与化学反应无关 | |
| C. | 我国目前最主要的能源是煤炭 | |
| D. | 煤、石油、天然气是当今世界最重要的三种化石燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
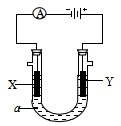 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
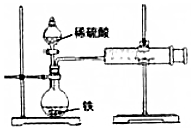 某小组的同学们利用如图装置,探究不同条件对铁与酸反应速率的影响.
某小组的同学们利用如图装置,探究不同条件对铁与酸反应速率的影响.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com