
下列各组物质的性质比较,不正确的是( )
A.酸性:HClO4>H3PO4>H2SO4
B.氢化物稳定性:HF>H2O>NH3
C.碱性:NaOH>Mg(OH)2>Al(OH)3
D.氧化性:F2>O2>N2
科目:高中化学 来源: 题型:
下列反应中,既是化合反应,又是氧化还原反应的是( )
①铁和氯气反应:2Fe+3Cl2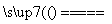 2FeCl3
2FeCl3
②氯气通入溴化钠溶液:Cl2+2NaBr===2NaCl+Br2
③氯化钠溶液和浓硫酸混合加热:2NaCl+H2SO4(浓)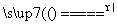 Na2SO4+2HCl↑
Na2SO4+2HCl↑
④二氧化锰跟浓盐酸在加热条件下反应:
MnO2+4HCl(浓)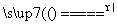 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
⑤氢气在氯气中燃烧:H2+Cl2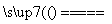 2HCl
2HCl
A.①② B.①③ C.①④ D.①⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
现有Al2(SO4)3和MgCl2的混合溶液,向其中逐滴加入NaOH溶液,得到沉淀的物质的量(W)与加入NaOH溶液的体积关系如图所示,则原溶液中SO42-与Cl-的物质的量之比为( )
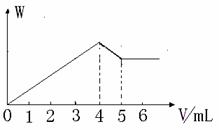
A. 1:1 B. 3:2 C. 2:3 D. 2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
科学家预测,原子序数为114的元素具有相当稳定的同位素,它在元素周期表中的位置是( )
A.第5周期、ⅣA族 B.第6周期、ⅥA族
C.第7周期、ⅣA族 D.第7周期、ⅥA族
查看答案和解析>>
科目:高中化学 来源: 题型:
下表所列是五种短周期元素的原子半径及主要化合价(已知铍的原子半径为0.090 nm)。
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.130 | 0.118 | 0.102 | 0.099 | 0.073 |
| 主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
(1)用元素代号标出它们在周期表中的对应位置(以下为周期表的一部分)。
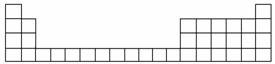
(2)A元素处于周期表中第________周期________族。
查看答案和解析>>
科目:高中化学 来源: 题型:
a、b、c、d、e、f、g为7种短周期元素构成的粒子,它们都有10个电子,其结构特点如下:
| 粒子 | a | b | c | d | e | f | g |
| 原子核数 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
| 所带电荷数 | 0 | +1 | -1 | 0 | +2 | +1 | 0 |
其中d是四原子分子,c与f反应可生成2个g分子。
试写出:
(1)b与e相应元素对应氧化物的水化物碱性强弱:________>________(用化学式表示)。
(2)b与e的离子半径:________>________(填元素符号)。
(3)c粒子是________;f粒子是________。(用化学式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
在强酸性无色透明溶液中,下列各组离子能大量共存的是( )
A.Cu2+、K+、Cl-、NO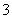
B.Ag+、Na+、NO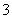 、Cl-
、Cl-
C.K+、Al3+、SO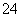 、Cl-
、Cl-
D.Ba2+、NH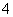 、Cl-、HCO
、Cl-、HCO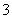
查看答案和解析>>
科目:高中化学 来源: 题型:
实验中需要2 mol·L-1的Na2CO3溶液950 mL,配制时,你认为应该选用的容量瓶的规格和称取的碳酸钠质量分别是( )
A.1 000 mL,212 g B.950 mL,201.4 g
C.500 mL,286 g D.任意规格,572 g
查看答案和解析>>
科目:高中化学 来源: 题型:
向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是
| 操作 | 现象 | 结论 | |
| A | 滴加BaCl2溶液 | 生成白色沉淀 | 原溶液中有SO42- |
| B | 滴加氯水和CCl4,振荡、静置 | 下层溶液显紫色 | 原溶液中有I- |
| C | 滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
| D | 加入稀盐酸,将产生的气体通入澄清石灰水中 | 溶液变浑浊 | 原溶液中一定含有CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com