
【题目】已知25℃、101kPa下,断开1mol H2中的化学键需吸收436kJ的热量,断开1mol Cl2中的化学键需吸收243kJ的热量,断开1mol HCl分子中的化学键需吸收431kJ的热量,试求5mol H2和5mol Cl2完全反应的能量变化为kJ(填“吸收或放出”+能量数值).
 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】下列叙述错误的是
A. 常温下,pH=3的盐酸与pH=11的氨水溶液中水的电离程度相同
B. 常温下两种溶液①0.1mol/L CH3COOH溶液 ②0.3mol/L CH3COOH溶液与0.1mol/L NaOH溶液等体积的混合液,c(H+):①>②
C. 室温下向10mL pH=3的醋酸溶液中加入水稀释后溶液中c(CH3COO-)/[c(CH3COOH)·c(OH-)]不变
D. MOH和ROH两种碱的溶液分别加水稀释时,pH变化如图所示则稀释前,c(ROH)<10c(MOH)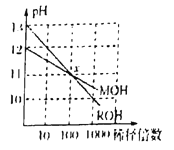
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合气体通过溴水(使其褪色),再通过灼热的氧化铜(使其黑色变红色),再通过无水CuSO4白色粉末(使其变蓝色),再通过澄清石灰水(石灰水由清变浑再变清),最后剩余气体在空气中点燃,火焰呈淡蓝色,这混合气体是( )
A.水煤气
B.焦炉煤气
C.石油液化气
D.高炉煤气(含CO、CO2和N2等)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,由酸(HM) 及其盐(NaM) 组成的混合溶液,起始浓度均为1mol/L。向该溶液中通入HCl气体或加入NaOH固体时,溶液pH的变化曲线如图所示。下列说法不正确的是
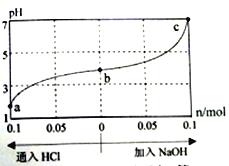
A. HM是弱酸 B. 加入NaOH过程中, 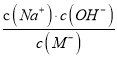 的值减小
的值减小
C. c点时,溶液中c(Na+)=c(M-) D. a、b、c对应溶液中,水的电离程度: a<b<c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸铜(Cu2(OH)2CO3)是名贵的矿物宝石孔雀石的主要成分,应用广泛,如在无机工业中用于制造各种铜化合物,有机工业中用作有机合成催化剂等等,某化学小组为了探究碱式碳酸铜生成条件对其产率的影响,设计了如下实验:
设计原理:取一定体积的碳酸钠溶液(0.5mol/L)于100mL烧杯中,进行加热,恒温后将硫酸铜溶液(5.00mL,0.5mol/L)在不断搅拌下以一定速度逐滴加入到上述碳酸钠溶液中,反应达平衡后,静止,减压过滤,洗涤,烘干,即得到最终产品,同时有气体放出。
(1)反应原理为:________________________________ 。
(2)探究反应原料用量比对反应产物的影响。
该化学小组根据所提供试剂设计两个实验,来说明反应原料用量对产品的影响。
提供试剂:0.5mol/LNa2CO3溶液、0.5mol/L CuSO4溶液
①填写下表的空白处:_____________、_____________。

②通过实验画图可知:当比值为_____________ ,碱式碳酸铜产量最好。

(3)反应温度对产率的影响
在三支试管中各加入2.0 mL 0.5 mol·L-1CuSO4溶液,另取四支试管各加入由上述实验得到的合适用量的0.5 mol·L-1 Na2CO3溶液。从这两列试管中各取一支将它们分别置于室温、30℃、50℃、100℃的环境中,数分钟后将CuSO4溶液倒入Na2CO3溶液中振荡并观察现象,发现:沉淀颜色分别为蓝色沉淀,绿色沉淀,深绿色沉淀,绿色中带有黑色沉淀,实验结果也如上图所示,请思考,为什么温度过高产率反而下降________________,该实验加热方式为_______________________。
(4)分析所制得的碱式碳酸铜的质量分数。
将已准确称量的0.5g试样放入300mL的锥形瓶中,加入5mL醋酸加热使其溶解,再用100mL水将其稀释。加入2.5gKI振荡混合,经过5分钟后,加入数滴淀粉溶液,用0.1mol/L的硫代硫酸钠溶液进行滴定。当_____________________ 时即达滴定的终点。
(5)反应的原理:2Cu2+ + 4I— == 2CuI + I2 ,I2+2 S2O32— == 2 I—+ S2O6 2—。 若消耗0.1mol/L硫代硫酸钠40 mL,则试样中铜的质量百分率为________________ 。
该溶液的滴定度为______________。(每毫升标准溶液相当于被测物质的质量,单位是g/mL或mg/mL)(保留三位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的说法中正确的是
A. 苯分子中6个碳原子之间的化学键完全相同
B. 苯分子中含有碳碳双键,能使酸性高锰酸钾溶液褪色
C. 在催化剂存在下,苯能与溴水发生取代反应,生成溴苯
D. 苯是一种密度比水大,不溶于水的有特殊气味的无色液体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图所示装置(假设溶液体积不变),下列叙述正确的是( )
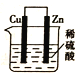
A. 烧杯内溶液中阳离子的物质的量浓度总和逐渐减小 B. 反应一段时间后,溶液逐渐变为蓝色
C. 逐渐溶解的一极上发生还原反应 D. 电子从产生大量气泡的一极流出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某溶液中含有Cl﹣、Br﹣、I﹣的物质的量之比为2:3:4,要使溶液中Cl﹣、Br﹣、I﹣的物质的量之比为4:3:2,则通入的Cl2物质的量是原溶液中I﹣物质的量的( )
A.![]()
B.![]()
C.![]()
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氯气的叙述正确的是
A. 氯气可用于漂白,这是氯气的漂白作用
B. 纯净的氢气可以在氯气中安静地燃烧,发出苍白色火焰
C. 钠在氯气中燃烧产生白色烟雾
D. 红热的铜丝可以在氯气中燃烧,产生棕黄色烟雾
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com