

| T/℃ | T1 | 300 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
分析 (1)根据平衡常数表达式以及各种物质的浓度知识来回答;平衡常数是温度的函数温度不变平衡常数不变;
(2)温度和平衡常数间的关系取决于平衡受温度的影响情况;
(3)氨的催化氧化产物是一氧化氮和水;
(4)氨气在纯氧中燃烧,生成氮气和水,燃料电池中,燃料做负极.
解答 解:(1)根据题意:CO+H2O(g)?CO2 +H2
初始浓度:0.2 0.3 0 0
变化浓度:0.12 0.12 0.12 0.12
平衡时的浓度:0.08 0.18 0.12 0.12
则K=$\frac{0.12×0.12}{0.08×0.18}$=1,平衡常数是温度的函数,所以温度不变平衡常数不变,
故答案为:1;不变;
(2)对于放热反应,温度越高,则化学平衡逆向移动,导致平衡常数减小,所以T1<300℃,故答案为:<;
(3)氧化炉中是氨的催化氧反应,方程式为:4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O,故答案为:4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O;
(4)氨气在纯氧中燃烧,生成氮气和水,化学方程式为:4NH3+3O2$\frac{\underline{\;点燃\;}}{\;}$N2+6H2O,在燃料电池中,燃料做负极,则通入氨气的电极是负极,碱性条件下,该电极发生反应的电极反应式为2NH3-6e-+6OH-→N2+6H2O,故答案为:4NH3+3O2$\frac{\underline{\;点燃\;}}{\;}$N2+6H2O;负极;2NH3-6e-+6OH-=N2+6H2O.
点评 本题是一道工业合成氨的综合性知识题目,可以根据所学知识进行回答,难度较大.


科目:高中化学 来源: 题型:解答题
 ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏时,应使温度计水银球与蒸馏烧瓶支管口在同一高度处 | |
| C. | 在苯甲酸重结晶实验中,粗苯甲酸加热溶解后,还需加少量蒸馏水再趁热过滤 | |
| D. | 除去混在苯中的苯酚时,可先加入饱和浓溴水,振荡后静置,再过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 同周期元素中X的金属性最强 | |
| B. | 原子半径X>Y,离子半径X+>Z2- | |
| C. | 同族元素中Z的氢化物沸点最低 | |
| D. | 同周期元素中Y的最高价含氧酸的酸性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C4H10属于烷烃的同分异构体有3种 | |
| B. | 结构为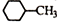 的一溴代物有5种 的一溴代物有5种 | |
| C. | 分子组成是C4H80属于醛类的同分异构体有3种 | |
| D. | 分子组成是C5H10O2属于羧酸的同分异构体有5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纤维素、蔗糖、葡萄糖和脂肪在一定条件下都可发生水解反应 | |
| B. | 油脂都不能使溴的四氯化碳溶液褪色 | |
| C. | 提纯鸡蛋白中的蛋白质时,可向鸡蛋清溶液中加入浓硫酸铵溶液,然后将所得沉淀滤出,经洗涤即得到较纯净的蛋白质 | |
| D. | 石油分馏是化学变化,而煤的干馏为物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2晶体易溶于水,水溶液呈现酸性 | |
| B. | CO2通入水玻璃中不可能得到硅酸 | |
| C. | SiO2是酸性氧化物,它不溶于任何酸 | |
| D. | SiO2+Na2CO3$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑是制造玻璃的反应之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、K+、SO42-、Br- | B. | Fe3+、Mg2+、HCO3-、Cl- | ||
| C. | H+、K+、I-、ClO- | D. | Ag+、NH4+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
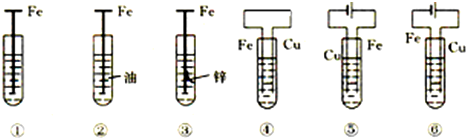
| A. | ③是牺牲阳极的阴极保护法 | |
| B. | 若将⑥的Cu极换成不溶性电极,则⑥是外加电流的阴极保护法 | |
| C. | 腐蚀快到慢的顺序为⑤>④>①>⑥>③>② | |
| D. | ①发生析氢腐蚀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com