
【题目】下表是元素周期表的一部分。
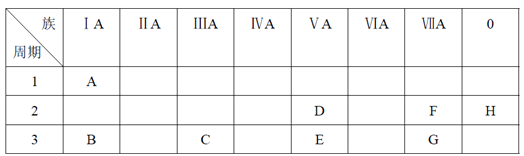
根据A~G元素在周期表中的位置,用化学式填写空白。
(1)氧化性最强的单质是______,还原性最强的单质是______,化学性质最不活泼的单质是______。(填相应的化学式)
(2)最稳定的氢化物是______。(填相应的化学式)
(3)一个E原子的核外电子总共有______种运动状态。
(4)按碱性逐渐减弱、酸性逐渐增强的顺序,将B、C、E、G四种元素的最高价氧化物对应水化物的化学式排列成序是_______。(填相应的化学式)
【答案】 F2 Na Ne HF 15 NaOH Al(OH)3 H3PO4 HClO4
【解析】分析:首先依据A~G元素在周期表中的位置判断出元素名称,然后结合元素周期律和相关物质的性质分析解答。
详解:根据A~G元素在周期表中的位置可知A是H,B是Na,C是Al,D是N,E是P,F是F,G是Cl,H是Ne。则
(1)氟是最活泼的非金属,则氧化性最强的单质是F2,所给元素中钠的金属性最强,则还原性最强的单质是Na,化学性质最不活泼的单质是稀有气体分子Ne。
(2)非金属性越强,氢化物越稳定,则最稳定的氢化物是HF。
(3)P原子核外电子数是15个,因此一个P原子的核外电子总共有15种运动状态。
(4)金属性越强,最高价氧化物水化物的碱性越强,非金属性越强,最高价含氧酸的酸性越强,则按碱性逐渐减弱、酸性逐渐增强的顺序,将B、C、E、G四种元素的最高价氧化物对应水化物的化学式排列成序为NaOH、Al(OH)3、H3PO4、HClO4。


科目:高中化学 来源: 题型:
【题目】b mL Al2(SO4)3溶液中含有agSO42-,若把此溶液取一半加水稀释至2b mL,则稀释后溶液中Al3+的物质的量浓度为
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图为氯化钠的晶体结构模型,下列说法不正确的是
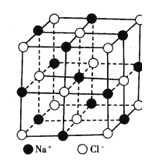
A.NaC1晶体中Na+与C1— 的个数比为1:1
B.每个Na+周围距离最近的C1— 数为6
C.和Na+距离相等且最近的C1— 构成的多面体是正八面体
D.每个Na+周围距离最近的Na+数为8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、Be、Cl、Fe等元素及其化合物有重要的应用。
(1)查表得知,Be的电负性是1.5,Cl的电负性是3.0,则BeCl2应为 (填离子或共价)化合物;根据铍元素和铝元素在周期表中的位置,推测BeCl2应与 (填MgCl2或AlCl3)化学性质更相似。
(2)上述四种元素的原子中,未成对电子数最多的元素是_________________。
(3)①试根据原子核外电子排布所遵循的原理解释Fe2+具有较的强还原性,易被氧化为Fe3+的原因 。②当然Fe3+也有氧化性,在印刷行业中就用氯化铁溶液腐蚀铜板,写出离子方程式 。
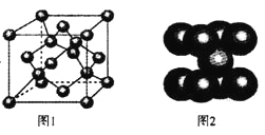
(4)一定条件下,C元素可形成多种晶体。下图1是其中某种晶体的一个晶胞,该晶胞中含有________个C原子。
(5)下图2为金属铁某种晶体的晶胞结构,已知铁的摩尔质量是56gmol-1,该晶体的密度为a gcm-3,NA为阿伏加德罗常数的值,则该晶胞的体积为_________cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化中,不能说明SO2是酸性氧化物的是( )
A. 二氧化硫与水化合生成亚硫酸
B. 二氧化硫与氢氧化钠反应生成亚硫酸钠和水
C. 二氧化硫被催化氧化变为三氧化硫
D. 二氧化硫与氧化钙化合生成亚硫酸钙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的工业原料,工业上利用反应3Cl2+2NH3=N2+6HCl检查氯气管道是否漏气,下列说法错误的是
A.若管道漏气遇氨就会产生白烟
B.该反应利用了Cl2的强氧化性
C.该反应NH3被还原
D.生成1 mol N2有6 mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种粒子。其中N2、ClO-的物质的量随时间变化的曲线如图所示。下列判断不正确的是
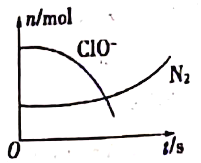
A. 该反应的氧化剂是ClO-
B. 消耗1mol还原剂,转移3mol电子
C. 氧化剂与还原剂的物质的量之比为2:3
D. 该离子方程式为3ClO-+2NH4+=2H++N2↑+3Cl-+3H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com