
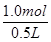 =2mol·L-1
=2mol·L-1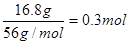
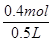 =0.8mol·L-1
=0.8mol·L-1

科目:高中化学 来源:不详 题型:单选题
| A.16 g | B.32 g | C.64 g /mol | D.32 g /mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①② | B.③④ | C.②④ | D.⑤⑥ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.100 ml 0.5 mol/L MgCL2溶液 | B.200 ml 0.25 mol/L HCL溶液 |
| C.50 ml 1 mol/L NaCL溶液 | D.200 ml 0.25 mol/L CaCL2溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①② | B.③④ | C.②④ | D.⑤⑥ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.物质的量可理解为物质的质量 |
| B.物质的量就是物质的粒子数目 |
| C.物质的量是度量物质所含微观粒子多少的一个物理量 |
| D.物质的量的单位——摩尔,只适用于分子、原子和离子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.17g甲基(—14CH3)所含中子数为9NA |
| B.常温常压下,2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2NA |
| C.0.1molC5H12分子中含有的C-C键数为0.5NA |
| D.标准状况下,2.24L辛烷在氧气中完全燃烧生成CO2分子数为0.8 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com