
����Ŀ���״���ˮ�������������ֱ������ȼ�ϵ�ء��ش��������⣺
(1)��֪�״��ֽⷴӦ��CH3OH(g)![]() CO(g)��2H2(g) ��H1����90.64 kJ��mol��1��
CO(g)��2H2(g) ��H1����90.64 kJ��mol��1��
ˮ�����任��Ӧ��CO(g)��H2O(g)![]() CO2(g)��H2(g) ��H2����41.20 kJ��mol��1��
CO2(g)��H2(g) ��H2����41.20 kJ��mol��1��
��CH3OH(g)��H2O(g)![]() CO2(g)��3H2(g) ��H3��___________kJ��mol��1��
CO2(g)��3H2(g) ��H3��___________kJ��mol��1��
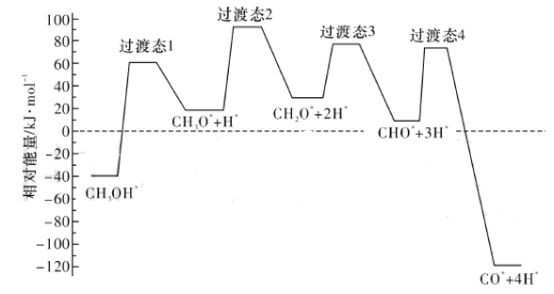
(2)��ѧ��ͨ���ܶȷ��������о��״���ˮ�����������ⷴӦ����ʱ���õ��״���Pd(III)���淢������ʱ�ĸ�·������������Ĺ�ϵ��ͼ��ʾ�����и���Pd(III)�����������*��ע���������л����С�ķ�Ӧ����ʽΪ_____________________________________________��
(3)��0.1MPa�£����ܽ�����Ϊ1 mol��n(CH3OH)��n(H2O)��1��1.3�Ļ���������һ�����ܱ������з�Ӧ��
��ʵ����ˮ�����任��Ӧ���������¶ȵ����������½���ԭ����____________________��
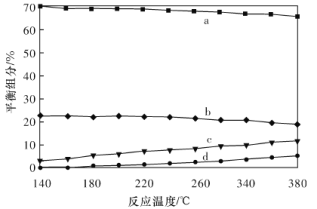
��ƽ��ʱ�����CH3OH�ĺ����ڸ����¶ȷ�Χ�ڼ�С��H2��H2O(g)��CO��CO2������ֵĺ����뷴Ӧ�¶ȵĹ�ϵ��ͼ��ʾ������b��c��Ӧ���ʵĻ�ѧʽ�ֱ�Ϊ________��________��
(4)573.2Kʱ����һ�����ܱ������г���5.00 MPa CH3OHʹ��ֽ⣬t h���ƽ��ʱH2�����ʵ�������Ϊ60%����t h��v(CH3OH)��_____MPa��h��1�����ѹƽ�ⳣ��Kp��_____MPa2��
���𰸡�+49.44 CH2O*+2H*=CHO*+3H*����CH2O*=CHO*+H*�� ���¶����ߣ������Խ��� CO2 H2O��g�� ![]() 168.75
168.75
��������
��1���״��ֽⷴӦ��CH3OH(g)![]() CO(g)��2H2(g) ��H1����90.64 kJ��mol��1����
CO(g)��2H2(g) ��H1����90.64 kJ��mol��1����
ˮ�����任��Ӧ��CO(g)��H2O(g)![]() CO2(g)��H2(g) ��H2����41.20 kJ��mol��1����
CO2(g)��H2(g) ��H2����41.20 kJ��mol��1����
����+�ڣ��������CH3OH(g)��H2O(g)![]() CO2(g)��3H2(g) ��H3��=+90.64 kJ��mol��1+��-41.20 kJ��mol��1��=+49.44 kJ��mol��1���ʴ�Ϊ��+49.44��
CO2(g)��3H2(g) ��H3��=+90.64 kJ��mol��1+��-41.20 kJ��mol��1��=+49.44 kJ��mol��1���ʴ�Ϊ��+49.44��
��2�����Ϊ��Ӧ��������������̬����֮���ͼ�п��Կ���������̬3�����ķ�Ӧ�����С����Ӧ��Ϊ��CH2O*+2H*��������Ϊ��CHO*+3H*���ʷ�Ӧ����ʽΪCH2O*+2H*=CHO*+3H*����Ϊ2H*��Ӧǰ�������ڴ������棬δ���뷴Ӧ���ʷ�Ӧʵ��ΪCH2O*=CHO*+H*���ʴ�Ϊ��CH2O*+2H*=CHO*+3H*����CH2O*=CHO*+H*����
��3����Ϊ�¶����ߣ���Ӧ����Ӧ�ӿ죬��ͼ�����ʼ�С����Ȼ�����¶ȵ�Ӱ�죬ֻ��Ϊ�����Ļ��Խ��ͣ��ʴ�Ϊ�����¶����ߣ������Խ��ͣ�
�ڶ��ڷ�ӦCO��g��+H2O��g��![]() CO2��g��+H2��g����H��0��������������ʱ�������¶ȣ�ƽ�������ƶ�����CO��H2O�ĺ���������CO2��H2�ĺ�������С������ͼ����Ϣ���ɳ�����֪��a��b���߷ֱ��ӦCO2��H2��c��d�������ӦCO��H2O��g�������ݷ�Ӧ����ʽ��֪���÷�Ӧ��ʼʱ��n��H2����n��CO2����n��H2O����n��CO����ƽ��ʱ������Ȼ��H2��CO2��H2O��CO����a��b��c��d���߷ֱ��ӦH2��CO2��H2O��g����CO������b��c��Ӧ���ʵĻ�ѧʽ�ֱ�ΪCO2��H2O��g�����ʴ�Ϊ��CO2��H2O��g����
CO2��g��+H2��g����H��0��������������ʱ�������¶ȣ�ƽ�������ƶ�����CO��H2O�ĺ���������CO2��H2�ĺ�������С������ͼ����Ϣ���ɳ�����֪��a��b���߷ֱ��ӦCO2��H2��c��d�������ӦCO��H2O��g�������ݷ�Ӧ����ʽ��֪���÷�Ӧ��ʼʱ��n��H2����n��CO2����n��H2O����n��CO����ƽ��ʱ������Ȼ��H2��CO2��H2O��CO����a��b��c��d���߷ֱ��ӦH2��CO2��H2O��g����CO������b��c��Ӧ���ʵĻ�ѧʽ�ֱ�ΪCO2��H2O��g�����ʴ�Ϊ��CO2��H2O��g����
��4������CH3OH��ѹǿ�仯��Ϊx���г�����ʽ��

![]() ��x=3.75Mpa��v��CH3OH��=
��x=3.75Mpa��v��CH3OH��=![]() =
=![]() MPa��h��1��Kp=
MPa��h��1��Kp=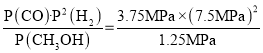 =168.75��MPa��2��
=168.75��MPa��2��
�ʴ�Ϊ��![]() ��168.75��MPa��
��168.75��MPa��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��2Fe2++Cl2=2Cl��+2Fe3+��2Br��+Cl2=Br2+2Cl����2Fe2++Br2=2Br��+2Fe3+����bL FeBr2��Һ��ͨ��amol Cl2ʱ��ʹ��Һ��50% ��Br������ΪBr2����ԭFeBr2�����ʵ���Ũ��Ϊ
A. a/bmolL��1 B. 2a/bmolL��1 C. 3a/bmolL��1 D. 5a/bmolL��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��﮷��������ص������ܶ�ԶԶ�����������ϵ�أ���ɱ��ͣ����ڴ����ƹ㣬�ҶԻ�������Ⱦ����֪��ص��ܷ�ӦΪV2O5��xLi![]() LixV2O5������˵����ȷ����
LixV2O5������˵����ȷ����
A. ����ڷŵ�ʱ��Li�����Դ�����ƶ�
B. ���ʱ�����ķ�ӦΪLixV2O5��xe��===V2O5��xLi��
C. �ŵ�ʱ����ʧ��7.0 g����ת��2 mol����
D. �õ����Li��V2O5Ϊ�缫��������Һ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��B��N��Ti��Fe������Ҫ�IJ���Ԫ�أ��䵥�ʼ�����������������ж��й㷺��Ӧ�á�
��1����̬Fe2���ĵ����Ų�ʽΪ_____��Tiԭ�Ӻ����________���˶�״̬��ͬ�ĵ��ӡ�
��2��BH3������NH3���ӵĿռ�ṹ�ֱ�Ϊ_________��BH3��NH3��Ӧ���ɵ�BH3��NH3�����к��еĻ�ѧ��������_______����BH3��NH3��Bԭ�ӵ��ӻ���ʽΪ________��
��3��N��Pͬ���塣��ѧ��Ŀǰ�ϳ���N4���ӣ��÷�����N��N��N���ļ���Ϊ________��N4�ֽ���ܲ���N2���ͷų������������Ʋ�����;___________��(д��һ�ּ���)
��4��NH3��Cu2�����γ�[Cu(NH3)4]2�������ӡ���֪NF3��NH3������ͬ�Ŀռ乹�ͣ���NF3������Cu2���γ������ӣ���ԭ����____��
��5������TiO2��һ��Ӧ�ù㷺�Ĵ����������һ��ʵ����ͼ��ʾ���������ҵķе����Ը��ڻ�����ף���Ҫԭ����______�����������в�ȡsp3�ӻ���ԭ�ӵĵ�һ�������ɴ�С��˳��Ϊ________��
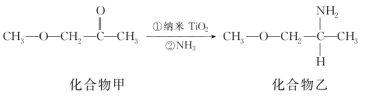
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�кܶ���Ҫ�Ļ���ԭ�϶���Դ��ʯ�ͻ�������ͼ�еı�����ϩ���л���A�ȣ�����A�IJ���������������һ�����ҵ�ʯ�ͻ�����չˮƽ����ش��������⣺
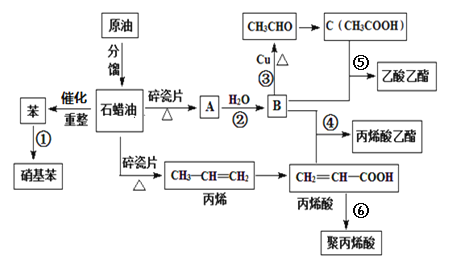
��1����ϩ���к��������ŵ�����Ϊ___��
��2��д�����з�Ӧ�ķ�Ӧ���͢�___����___��
��3������˵����ȷ������__________��
A.�������л���ŨHNO3��H2SO4�����䵹�뵽NaOH��Һ�У����ã���Һ
B.��ȥ���������е����ᣬ��NaOH��Һ����Һ
C.�۱�ϩ���ܹ�ʹ���Ը��������Һ��ɫ
D.�л���C���ϩ������ͬϵ��
��4��д�����з�Ӧ����ʽ��
��B��CH3CHO___��
�ܱ�ϩ��+B����ϩ������___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ȳ(C2H2)������������л��ϳ�����;�dz��㷺�����ɵ�ʯ(CaC2)ֱ��ˮ�����������1500�����������ѽⷨ������
(1)��ʯˮ��������Ȳ�ǽ���ʯ���뽹̿��3000���·�Ӧ����CaC2��CaC2����ˮ��Ӧ���õ���Ȳ��CaC2��ˮ��Ӧ�Ļ�ѧ����ʽΪ____
(2)��֪��CH4(g)+2O2(g)===CO2(g)+2H2O(1) ��H1=��890.3kJ/mol
C2H2(g)+2.50(g)===2CO2(g)+H2O(1) ��H2=��1299.6J/mol
2H2(g)+O2(g)=2H2O(1) ��H3=��571.6kJ/mol
����������ѽⷴӦ��2CH4(g)===C2H2(g)+3H2(g)����H=_____kJ/mol��
(3)��˹���о��ó�������ֽ�ʱ����������ƽ��ʱ��ѹ(Pa)���¶�(��)�Ĺ�ϵ��ͼ��ʾ��
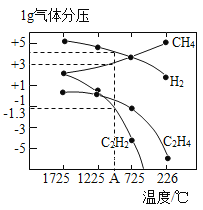
��T1��ʱ����1L�����ܱ������г���0.3 mol CH4ֻ������Ӧ2CH4(g)![]() C2H4(g)+2H2(g)���ﵽƽ��ʱ�����c(C2H4)=c(CH4)���÷�Ӧ����H____0(����>������<��)��CH4��ƽ��ת����Ϊ____%(����3λ��Ч����)������ƽ��״̬ijһʱ�̣����ı��¶���T2�棬CH4��0.01mol/(L��s)��ƽ���������࣬��ts���ٴδﵽƽ�⣬ƽ��ʱ��c(CH4)=2c(C2H4)����T1_____(����>������<��)T2��t=______s��
C2H4(g)+2H2(g)���ﵽƽ��ʱ�����c(C2H4)=c(CH4)���÷�Ӧ����H____0(����>������<��)��CH4��ƽ��ת����Ϊ____%(����3λ��Ч����)������ƽ��״̬ijһʱ�̣����ı��¶���T2�棬CH4��0.01mol/(L��s)��ƽ���������࣬��ts���ٴδﵽƽ�⣬ƽ��ʱ��c(CH4)=2c(C2H4)����T1_____(����>������<��)T2��t=______s��
����ʽ���㷴Ӧ2CH4(g)![]() C2H2(g)+3H2(g)��ͼ��A���¶�ʱ��ƽ�ⳣ��K=____(��ƽ���ѹ����ƽ��Ũ�ȼ��㣬lg0.05=��1.3)��
C2H2(g)+3H2(g)��ͼ��A���¶�ʱ��ƽ�ⳣ��K=____(��ƽ���ѹ����ƽ��Ũ�ȼ��㣬lg0.05=��1.3)��
����ͼ��֪�������ѽ�����Ȳ�и�������ϩ���ɣ�Ϊ���������Ȳ��ת���ʣ����ı��¶��⣬���ɲ�ȡ�Ĵ�ʩ��___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����(����)
A. ���³�ѹ�£�4.6 g NO2����Լ����1.806��1023��ԭ��
B. ��״���£�80 g SO3��ռ�����ԼΪ22.4 L
C. ��״���£�22.4 L CCl4�к��е�CCl4������ΪNA
D. ��״���£�22.4 L��������������������Һ��Ӧ��ת�Ƶĵ�����Ϊ2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. �ǻ�����������������ͬ�Ļ�ѧʽ�͵���ʽ
B. �Ҵ��Ĺ���������OH������NaOH��Һ�����кͷ�Ӧ
C. �����£�1 mol�Ҵ�����������Na��Ӧ����11.2 L H2
D. ��֪�Ҵ��Ľṹʽ��ͼ��ʾ�����Ҵ�������ʱ���ѵĻ�ѧ��Ϊ�٢�
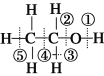
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���R�Ǻϳ�ijҩ����м��壬�ṹ��ʽΪ![]() ������˵����ȷ����
������˵����ȷ����
A.R��M( )��Ϊͬ���칹��B.R������̼ԭ��һ������ͬһƽ��
)��Ϊͬ���칹��B.R������̼ԭ��һ������ͬһƽ��
C.R����Ԫ���ϵ�һ�ȴ�����4��D.R�ܷ���ȡ����Ӧ���ӳɷ�Ӧ��������Ӧ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com