
【题目】明矾石的主要成分是K2SO4·Al2(SO4)3·2Al2O3·6H2O,含有少量氧化铁,利用明矾石制备K2SO4的工艺流程如图所示:
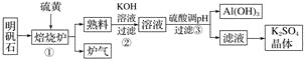
据此流程图回答下列问题:
(1)①焙烧炉中Al2(SO4)3与S反应的产物是两种氧化物,该反应的化学方程式为______;写出炉气的一种用途________。
(2)②中Al2O3参与反应的离子方程式为__________。
(3)③中调节pH不能用CO2的理由是____________________。
(4)工业冶炼金属铝需要定期更换补充阳极碳块的原因是__________________。
(5)纯净氢氧化铝经历两次__________________(填反应类型)可制得铝。以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池负极的电极反应式是__________________。
(6)现有明矾石1 625 t,按上述流程制得780 t Al(OH)3,忽略铝元素的损失,请计算明矾石中钾元素的质量分数为____________%。
【答案】2Al2(SO4)3+3S![]() 2Al2O3+9SO2↑ 用于工业制硫酸 Al2O3+2OH-===2
2Al2O3+9SO2↑ 用于工业制硫酸 Al2O3+2OH-===2![]() +H2O ③中调节pH不能用CO2,因为偏铝酸钾与二氧化碳反应会生成碳酸钾,使制备的K2SO4中有杂质 阳极会产生氧气,阳极的碳块在高温时会与氧气反应 分解反应 Al-3e-+4OH-===
+H2O ③中调节pH不能用CO2,因为偏铝酸钾与二氧化碳反应会生成碳酸钾,使制备的K2SO4中有杂质 阳极会产生氧气,阳极的碳块在高温时会与氧气反应 分解反应 Al-3e-+4OH-===![]() +2H2O 8
+2H2O 8
【解析】
根据题中工业流程可知,明矾石与硫在加热的条件下生成二氧化硫和氧化铝,所以炉气中主要有二氧化硫,熟料中主要是氧化铝,氧化铝溶解在氢氧化钾溶液中,得到偏铝酸钾溶液,用稀硫酸调节PH值,可得氢氧化铝沉淀和硫酸钾溶液,从硫酸钾溶液中可得硫酸钾晶体,据此答题。
(1)①焙烧炉中Al2(SO4)3与S反应的产物是两种氧化物,反应的化学方程式为2Al2(SO4)3+3S![]() 2Al2O3+9SO2,炉气的主要成份是二氧化硫,其一种用途为用于工业制硫酸,故答案为:2Al2(SO4)3+3S
2Al2O3+9SO2,炉气的主要成份是二氧化硫,其一种用途为用于工业制硫酸,故答案为:2Al2(SO4)3+3S![]() 2Al2O3+9SO2;用于工业制硫酸;
2Al2O3+9SO2;用于工业制硫酸;
(2)反应②为Al2O3与氢氧化钾的反应,反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O;
(3)③中调节pH不能用CO2,因为偏铝酸钾与二氧化碳反应会生成碳酸钾,使制备的K2SO4中有杂质,故答案为:偏铝酸钾与二氧化碳反应会生成碳酸钾,使制备的K2SO4中有杂质;
(4)工业冶炼金属铝是用电解熔融的氧化铝的方法,阳极会产生氧气,阳极的碳块在高温时会与氧气反应,所以要定期更换补充阳极碳块,
故答案为:阳极会产生氧气,阳极的碳块在高温时会与氧气反应;
(5)纯净氢氧化铝经过受热分解,再电解可制得铝,涉及的反应类型都是分解反应,以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,充当电池的正极,铝发生氧化反应充当电池的负极,所以电池负极的电极反应式是Al-3e-+4OH-=AlO2-+2H2O,故答案为:分解反应;Al-3e-+4OH-=AlO2-+2H2O;
(6)现有明矾石1625t,按上述流程制得780tAl(OH)3,根据明矾石的化学式K2SO4Al2(SO4)32Al2O36H2O可知,明矾石中铝元素与钾元素的物质的量之比为3:1,780tAl(OH)3中铝元素的物质的量为![]() ×106mol=1×107mol,所以钾元素的物质的量为
×106mol=1×107mol,所以钾元素的物质的量为![]() ×107mol,根据元素守恒可知,明矾石中钾元素的质量分数为
×107mol,根据元素守恒可知,明矾石中钾元素的质量分数为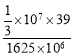 =0.08=8%,故答案为:8。
=0.08=8%,故答案为:8。


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】0.096 kg碳完全燃烧生成CO2气体可放出3147.9 kJ的热量,则下列热化学方程式正确的是( )
A. C(s)+O2(g)===CO2(g) ΔH=-393.49 kJ/mol
B. C(s)+O2(g)===CO2(g) ΔH=+393.49 kJ/mol
C. C+O2===CO2 ΔH=-393.49 kJ/mol
D. C(s)+![]() O2(g)===CO(g) ΔH=-393.49 kJ/mol
O2(g)===CO(g) ΔH=-393.49 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化六氨合钴([Co(NH3)6]Cl3)是一种橙黄色晶体,实验室制备过程如下:
Ⅰ.将研细的6 g CoCl26H2O晶体和4 g NH4Cl固体加入锥形瓶中,加水,加热溶解,冷却;
Ⅱ.加入13.5 mL浓氨水,用活性炭作催化剂,混合均匀后逐滴滴加13.5 mL 5% H2O2溶液,水浴加热至50~60℃,保持20 min。用冰浴冷却,过滤,得粗产品;
Ⅲ.将粗产品溶于50 mL热的稀盐酸中,______,向滤液中缓慢加入6.7 mL浓盐酸,有大量橙黄色晶体析出,冰浴冷却后过滤;
Ⅳ.先用冷的2 mol·L1 HCl溶液洗涤晶体,再用少许乙醇洗涤,干燥,得产品。
(1)[Co(NH3)6]Cl3中Co的化合价是______。
(2)CoCl2遇浓氨水生成Co(OH)2沉淀,加入浓氨水前先加入NH4Cl可避免沉淀生成,原因是______。
(3)溶液中CoCl2、NH4Cl和浓氨水混合后,与H2O2溶液反应生成[Co(NH3)6]Cl3的化学方程式是______。
(4)补全Ⅲ中的操作:______。
(5)沉淀滴定法测定制备的产品中Cl-的质量分数:
ⅰ.准确称取a g Ⅳ中的产品,配制成100 mL溶液,移取25 mL溶液于锥形瓶中;
ⅱ.滴加少量0.005 mol·L1 K2CrO4溶液作为指示剂,用c mol·L1 AgNO3溶液滴定至终点;
ⅲ.平行测定三次,消耗AgNO3溶液的体积的平均值为v mL,计算晶体中Cl-的质量分数。
已知:溶解度:AgCl 1.3×106 mol·L1,Ag2CrO4(砖红色)6.5×105 mol·L1
①ⅱ中,滴定至终点的现象是______。
②制备的晶体中Cl-的质量分数是______(列计算式,Cl的相对原子质量:35.5)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是

A.利用如图装置可制备Fe(OH)2
B.需要加热才能进行的化学反应一定是吸热反应
C.对铅蓄电池进形充电时,铅电极应连接外电源的正极
D.已知:H+(aq)+OH-(aq)=H2O(l) ΔH= -57.3 kJ·mol-1,若将1L 0.5mol·L-1盐酸与1L 0.55mol·L-1 NaOH的溶液混合,能放出28.65kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是
A.如图表示反应2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0在有无催化剂时的能量变化
2SO3(g) ΔH<0在有无催化剂时的能量变化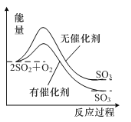
B.如图表示电解精炼铜时纯铜和粗铜的质量随时间的变化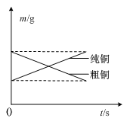
C.如图表示铅蓄电池放电时负极质量随转移电子物质的量的变化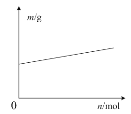
D.如图表示反应2NO2(g)![]() N2O4(g)和2NO2(g)
N2O4(g)和2NO2(g)![]() N2O4(l)的能量变化
N2O4(l)的能量变化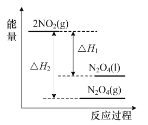
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】消除含氮化合物对大气和水体的污染是环境保护的重要研究课题。
(1)已知:反应Ⅰ N2(g)+O2(g)=2NO(g) ΔH=a kJ·mol-1
反应Ⅱ 2NO(g)+O2(g)=2NO2(g) ΔH=b kJ·mol-1
反应Ⅲ 4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH=c kJ·mol-1
①写出NO2和NH3反应生成N2和液态水的热化学反应方程式______。
②反应Ⅰ中各物质所含化学键键能总和数据如下表,a=______。
物质 | N2 | O2 | NO |
每摩尔物质所含键能总和/kJ·mol-1 | 946 | 498 | 630 |
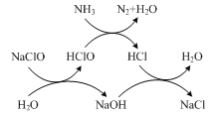
(2)用次氯酸钠除去氨氮的原理如图所示。该图示的总反应化学方程式为______。
(3)某微生物膜技术能利用电解原理将弱碱性水中的NO![]() 还原为N2,工作原理如图所示。
还原为N2,工作原理如图所示。
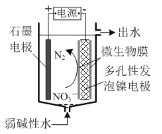
①写出阴极的电极反应式:______。
②理论上,若除去0.04 mol NO![]() ,阳极生成气体的体积为______。(标准状况)
,阳极生成气体的体积为______。(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氧化三铁俗称为磁性氧化铁,通常用作颜料、抛光剂和电讯器材等。某化学兴趣小组取磁性氧化铁进行铝热反应实验并对产物进行探究。
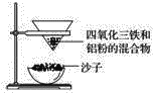
(1)取磁性氧化铁按图装置进行铝热反应,引发铝热反应的实验操作是__________。
(2)取少许反应生成的“铁块”溶于盐酸,滴加硫氰化钾溶液后溶液不变红,则______(填“能”或“不能”)说明“铁块”一定不含四氧化三铁,理由是_________。
(3)设计一个简单的实验方案,证明上述所得的“铁块”中含有金属铝,该实验所用的试剂是__________,反应的离子方程式为___________。
(4)请写出此铝热反应的化学方程式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知部分被氧化的镁条1.6 g,和足量的盐酸反应,在标准状况下生成H21.12 L,在跟盐酸反应前被氧化的镁是 ( )
A.1.2 gB.0.64 gC.0.4 gD.0.24 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,X是金属元素,W、Y是不同主族的非金属元素且最外层电子数为偶数,Y的原子序数是Z的最外层电子数的2倍,由W、X、Y三种元素形成的化合物M的结构如下图所示。下列叙述正确的是
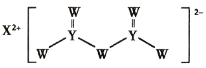
A.W、X离子半径比较:X>W
B.Y、Z的氢化物稳定性比较:Y>Z
C.1mol YW2晶体中含有4mol Y—W键
D.工业上可通过电解熔融XW来生产X的单质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com