
【题目】引起下列环境污染的原因不正确的是
A. 重金属、农药和难分解有机物等会造成水体污染
B. 装饰材料中的甲醛、芳香烃及氡等会造成居室污染
C. SO2、NO2或CO2都会导致酸雨的形成
D. CO2和氟氯烃等物质的大量排放会造成温室效应的加剧
 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
【题目】硫一钠原电池具有输出功率较高、循环寿命长等优点。其工作原理可表示为:![]() 。但工作温度过高是这种高性能电池的缺陷。科学家研究发现,采用多硫化合物[如
。但工作温度过高是这种高性能电池的缺陷。科学家研究发现,采用多硫化合物[如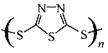 ]作为电极反应材料,可有效地降低电池的工作温度,且原材料价廉、低毒,具有生物降解性。下列关于此种多硫化合物的叙述正确的是
]作为电极反应材料,可有效地降低电池的工作温度,且原材料价廉、低毒,具有生物降解性。下列关于此种多硫化合物的叙述正确的是
A. 这是一种新型无机非金属材料 B. 此化合物可能发生加成反应
C. 原电池的负极反应将是单体![]() 转化为
转化为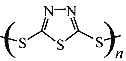 t的过程 D. 当电路中转移0.02mol电子时,将消耗原电池的正极反应材料1.48g
t的过程 D. 当电路中转移0.02mol电子时,将消耗原电池的正极反应材料1.48g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用HNO3和HF的混酸处理某金属后,产生的酸洗废液中含有Fe3+、Ni2+、![]() 、F和
、F和![]() 等。如图是综合利用该酸洗废液的工艺流程:
等。如图是综合利用该酸洗废液的工艺流程:

已知:
①金属离子开始沉淀和沉淀完全时的pH:
Fe3+ | Ni2+ | Cr3+ | |
开始沉淀 | 1.5 | 6.7 | 4.0 |
沉淀完全 | 3.4 | 9.5 | 6.9 |
②Ni2+与足量氨水的反应为:Ni2++6NH3![]() [Ni(NH3)6]2+
[Ni(NH3)6]2+
(1)再生酸中含有HNO3,采取减压蒸馏的目的为_________________________________。
(2)滤渣1的主要成分为____________。
(3)请写出“转化”时NaHSO3与![]() 发生反应的氧化剂与还原剂的物质的量之比:________。
发生反应的氧化剂与还原剂的物质的量之比:________。
(4)已知[Ni(NH3)6]2+为难电离的络合离子,则“沉镍”的离子方程式为______________________。
(5)滤渣3的主要成分为CaSO4、Ca(OH)2和________。
(6)经检测,最后的残液中c(Ca2+)=0.001 mol·L1,则残液中F-浓度为_______mg·L1,______(填“符合”或“不符合”)排放标准[已知Ksp(CaF2)=4×1011,国家排放标准要求氟离子浓度小于10 mg·L1]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液可能含有Na+、Ba2+、Al3+、Fe3+、Br-、CO32-等离子,取少量溶液往其中滴加氯水,有无色无味气体产生,溶液仍为无色;另取少量逐滴滴入NaOH 溶液至过量,无现象。关于该溶液的推测正确的是
A. 溶液中可能存在A13+ B. 溶液中可能存在Br-
C. 溶液中一定存在CO32- D. 溶液中可能存在Ba2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一干燥烧瓶,用排空气法收集氨气,做喷泉实验。当水充满约整个烧瓶容积的二分之一后,喷泉停止。烧瓶内的氨水的物质的量浓度是(按标准状况下计算)
A. 1mol·L-1 B. 0.029mol·L-1 C. 0.045mol·L-1 D. 不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】地下水受到硝酸盐污染已成为世界范围内一个相当普遍的环境问题。用零价铁去除水体中的硝酸盐(NO3-)是地下水修复研究的热点之一。
(1)Fe还原水体中NO3-的反应原理如图所示。
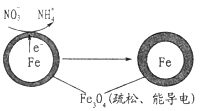
作负极的物质是___________;正极的电极反应式是_____________。
(2)将足量铁粉投入水体中,测定NO3-去除率和pH,结果如下:

在pH =4.5的水体中,NO3-的去除率低的原因是_____________。
(3)为提高pH =4.5的水体中NO3-的去除率,某课题组在初始pH =4.5的水体中分别投入①Fe2+、②Fe、③Fe和Fe2+做对比实验结果如图:

此实验可得出的结论是____,Fe2+的作用可能是_________。(2)中NO3-去除率和铁的最终物质形态不同的原因______________。
(4)地下水呈中性,在此条件下,要提高NO3-的去除速率,可采取的措施有_______。(写出一条)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D四种短周期主族元素,其中原子序数依次增大。已知B和D同主族。A元素的最高正价和最低负价的绝对值之差为2;1molC单质能与冷水反应,在标准状况下生成11.2LH2;D-的电子层结构与Ar原子相同。请回答下列问题:
⑴在下图塔式周期表相应位置标出A、B、C、D四种元素的元素符号。同时在图中将过渡元素涂黑。
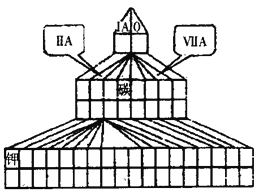 _____________
_____________
⑵用电子式表示B与C形成化合物的过程___________。
⑶图中“钾”和D形成的简单离子的半径大小为________________(用离子符号和“>”、“=”或“<”表示)。
⑷元素非金属性强弱比较有很多方法,其中A和D的非金属性强弱的研究方案中比较可行的是_______(填序号)。
①比较两种单质的颜色②比较氢化物的稳定性
③比较原子半径大小④比较最高价氧化物对应水化物的酸性
⑸A元素能与另外三种元素中的一种元素形成共价化合物,分子中的原子个数比为1:3,相对分子质量为120.5。则该物质的结构式为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com