
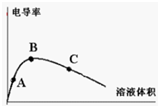
 某研究性学习小组为了探究醋酸的电离情况,进行了如下实验.
某研究性学习小组为了探究醋酸的电离情况,进行了如下实验.| 醋酸浓度(mol?L-1) | 0.0010 | 0.100 | 0.0200 | 0.1000 | 0.2000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
| 1.86×10-3mol/L |
| 0.2000mol/L |


科目:高中化学 来源: 题型:
| A、1:2:3 |
| B、3:2:1 |
| C、6:3:2 |
| D、1:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeCl3溶液中加入镁粉有气泡产生 |
| B、Cl2、SO2均能使品红溶液褪色,说明二者均有漂白性 |
| C、铅蓄电池在放电过程中,负极质量减小,正极质量增加 |
| D、向饱和NaCl溶液中先通入足量CO2,再通入足量NH3,可析出NaHCO3晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
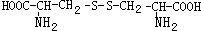
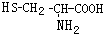 ,则下列说法错误的是
,则下列说法错误的是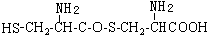
 可与NaOH溶液反应放出一种碱性气体.
可与NaOH溶液反应放出一种碱性气体.查看答案和解析>>
科目:高中化学 来源: 题型:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该元素是金属元素 |
| B、该元素原子的核电荷数为14 |
| C、该元素原子核外有3个电子层 |
| D、该元素原子不容易得到或者失去最外层电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com