
常温下,相同pH的氢氧化钠和醋酸钠溶液加水稀释,平衡时pH随溶液体积变化的曲线如图所示,则下列叙述不正确的是
A.b、c两点溶液的导电能力不相同
B.a、b、c三点溶液中水的电离程度a>c>b
C.c点溶液中C(H+) + C(CH3COOH)= C(OH-)
D.用相同浓度的盐酸分别与等体积的b、c处溶液
反应,消耗盐酸体积Vb=Vc
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
将6 g CH3COOH溶于水制得1 L溶液,此溶液的物质的量浓度为________________,经测定溶液中[CH3COO-]为1.4×10-3 mol·L-1,此温度下醋酸的电离常数:Ka=______________,温度升高Ka将________(填“变大”、“变小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组物质中,Y既能与X反应又能与Z反应的是( )
| X | Y | Z | |
| ① | NaOH溶液 | Al(OH)3 | 稀硫酸 |
| ② | KOH溶液 | SiO2 | 浓盐酸 |
| ③ | O2 | N2 | H2 |
| ④ | FeCl3溶液 | Cu | 浓硝酸 |
A.①③ B.①④ C.②④ D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
纳米材料二氧化钛(TiO2)具有很高的化学活性,可做性能优良的催化剂。工业上以金红石(主要成分是TiO2,主要杂质是SiO2)制取纳米级二氧化钛的流程如下:
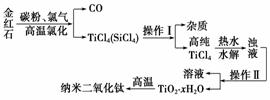
| 资料卡片 | ||
| 物质 | 熔点 | 沸点 |
| SiCl4 | -70 ℃ | 57.6 ℃ |
| TiCl4 | -25 ℃ | 136.5 ℃ |
(1)写出氯化时生成TiCl4的化学方程式________________________。
(2)操作Ⅰ、操作Ⅱ名称分别是____________________、____________。
(3)写出TiCl4水解的化学方程式________________。
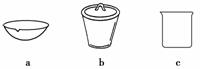
(4)如在实验室中完成灼烧TiO2·xH2O放在________(填字母序号)中加热。
(5)据报道:“生态马路”是在铺设时加入一定量的TiO2,TiO2受太阳光照射后,产生的电子被空气或水中的氧获得,生成H2O2。H2O2能清除路面空气中的CxHy、CO等,其主要是利用了H2O2的________(填“氧化性”或“还原性”)。
(6)某研究小组用下列装置模拟“生态马路”的部分原理并测定CO的转化效率(夹持装置已略去)。
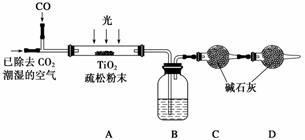
①B装置中的药品名称为________,若通入2.24 L(已折算成标准状况)CO气体和足量空气,最终测得装置A增重1.1 g,则CO的转化率为________。
②实验①中,当CO气体全部通入后,还要再通一会儿空气,其目的是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、L四种元素分别位于周期表中三个紧相邻的周期且原子序数依次增大,它们相关信息如下:
X元素原子的价电子构型为nsnnp2n
Y和Z位于同一周期,最外层都有两个未成对电子
L元素原子的基态未成对电子数是同周期最多的元素。
请回答如下问题:
(1)L元素在周期表中的位置是 。
该原子核外电子排布式是 。
其最高正价氧化物对应的水化物的化学式是 和 。
(2)元素X与Y形成的化合物晶体类型是 晶体
1mol该化合物含有的化学键数为 (用阿伏加德罗常数NA表示)
(3)元素M是周期表中电负性最强的元素,X与M形成的化合物XM2的分子几何构型是 ,该化合物中X原子的杂化轨道类型是 。
(4)X与碳、氢三种元素形成的相对分子质量最小的分子里有 个δ键, 个л键
(5)金属元素N与Z形成的离子化合物的晶胞结构如图,晶胞中Z离子数目为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.25 ℃时,在pH=2的1.0 L H2SO4溶液中含有H+数目为0.02NA
B.1 mol Na2O2固体中含离子总数与1 mol CH4中所含共价键数目相等
C.将含有1 mol FeCl3溶质的饱和溶液加入沸水中可以得到NA个Fe(OH)3胶粒
D.向含有FeI2的溶液中通入适量氯气,当有1 mol Fe2+被氧化时,该反应转移电子的数目至少为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
羟胺(NH2OH)是一种还原剂,能将某些氧化剂还原。现用25.00 mL 0.049 mol·L-1的羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+恰好与24.65 mL 0.020 mol·L-1的酸性KMnO4溶液完全作用,则在上述反应中,羟胺的氧化产物是[已知:FeSO4+KMnO4+H2SO4—→Fe2(SO4)3+K2SO4+MnSO4+H2O(未配平)]( )
A.N2 B.N2O C.NO D.NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
配平下列方程式
(1)在某强酸性混合稀土溶液中加入H2O2,调节pH≈3,Ce3+通过下列反应形成Ce(OH)4沉淀得以分离。完成反应的离子方程式:
 Ce3++
Ce3++ H2O2+
H2O2+ H2O===
H2O=== Ce(OH)4↓+
Ce(OH)4↓+ ________
________
(2)完成“氧化除铁”步骤中反应的离子方程式:
 Fe(OH)2+
Fe(OH)2+ ClO-+
ClO-+ ________===
________=== Fe(OH)3+
Fe(OH)3+ Cl-
Cl-
(3)配平反应的离子方程式:
 Mn2++
Mn2++ ClO
ClO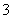 +
+ H2O===
H2O=== MnO2↓+
MnO2↓+ Cl2↑+
Cl2↑+ ________。
________。
(4)配平用钙线脱氧脱磷的化学方程式:
 P+
P+ FeO+
FeO+ CaO
CaO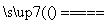
 Ca3(PO4)2+
Ca3(PO4)2+ Fe
Fe
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com