
 某学生为测定未知浓度的硫酸溶液,进行如下实验:用1.00mL待测硫酸溶液配制100mL稀H2SO4溶液;以0.14mol•L-1的NaOH溶液滴定上述稀H2SO4 25.00mL,滴定终止时消耗NaOH溶液15.00mL.
某学生为测定未知浓度的硫酸溶液,进行如下实验:用1.00mL待测硫酸溶液配制100mL稀H2SO4溶液;以0.14mol•L-1的NaOH溶液滴定上述稀H2SO4 25.00mL,滴定终止时消耗NaOH溶液15.00mL.分析 (1)①根据酸碱中和滴定操作正确的操作步骤进行排序,先检漏后洗涤、润洗滴定管装液重复操作;
②根据氢氧化钠与硫酸恰好中和溶液的pH为7选择使用的指示剂;
③根据滴定结束前硫酸溶液的颜色及反应结束后混合液的颜色变化判断滴定终点;
(2)滴定管没有润洗,滴定管内的蒸馏水导致盛装的溶液体积增大,溶液浓度减小;
(3)配制准确浓度的稀H2SO4溶液,配制100mL稀H2SO4溶液必须使用的主要容器是容量瓶;
(4)NaOH溶液为碱性溶液,应该用碱式滴定管量取;
(5)根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析;
(6)先根据滴定消耗的氢氧化钠溶液的体积及反应方程式计算出待测液硫酸的物质的量浓度,再根据稀释前后溶质的物质的量不变来计算.
解答 解:(1)①用标准0.14mol/L NaOH溶液滴定硫酸的实验操作步骤为:检查滴定管是否漏水、洗涤滴定管、润洗并盛装标准液、润洗盛装标准液的滴定管、盛装标准液、开始滴定、重复滴定等,所以正确的操作顺序为:ECDBAGF;
故答案为:ECDBAGF;
②由于氢氧化钠与硫酸恰好中和,溶液的pH=7,可以选用酚酞(变色范围为:8-10)作为指示剂,
故答案为:酚酞;
③滴定结束前,滴入酚酞的硫酸溶液为无色,滴定结束时,溶液变成红色,所以滴定终点现象为:滴入最后一滴NaOH溶液,溶液突然从无色变成浅红色(或粉红色),半分钟不褪色,
故答案为:滴入最后一滴NaOH溶液,溶液无色变为浅红色(或粉红色)且半分钟不褪去;
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗,相当于标准液被稀释,所以消耗掉的稀硫酸就会增多,滴定结果偏高,
故答案为:偏高;
(3)配制准确浓度的稀H2SO4溶液,配制100mL稀H2SO4溶液必须使用的主要容器是100mL容量瓶,
故答案为:100mL容量瓶;
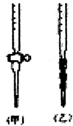
(4)NaOH溶液为碱性溶液,应该用碱式滴定管量取,即使用图中带有橡胶管和玻璃球的乙,
故答案为:乙;
(5)观察记录滴定管内液面刻度时滴定前仰视,滴定后俯视,造成V(标准)偏小,可知c(待测)偏低,
故答案为:偏低;
(6)以0.1400mol/L的NaOH溶液滴定上述H2SO4,取待测硫酸25.00mL,滴定终止时消耗NaOH溶液15.00mL,由关系式:
2NaOH~~~~~~~~~H2SO4;
2 1
0.1400mol/L×15.00mL C(H2SO4)×25.00mL×$\frac{1mL}{100mL}$
C(H2SO4)=$\frac{0.1400mol/L×15.00mL}{2×25.00mL×\frac{1mL}{100mL}}$=4.20mol/L;
故答案为:4.20mol/L.
点评 本题考查了酸碱中和滴定实验操作及误差分析,题目难度中等,要求学生熟记酸碱中和滴定的实验步骤和注意事项,侧重对学生能力的培养和解题方法的指导与训练,有利于培养学生规范的实验设计能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
| 实验 编号 | KOH溶液的 浓度/mol•L-1 | 滴定完成时,KOH溶液滴入的体积/mL | 待测盐的体积/mL酸 |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
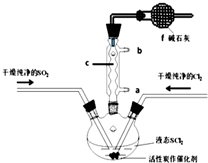 SOCl2是一种液态化合物,沸点为77℃,在农药、制药行业中用途广泛.SOCl2遇水剧烈反应,液面上产生白雾,并带有刺激性气味的气体产生.实验室合成原理:SO2+Cl2+SCl2=2SOCl2,部分装置如图所示,回答以下问题:
SOCl2是一种液态化合物,沸点为77℃,在农药、制药行业中用途广泛.SOCl2遇水剧烈反应,液面上产生白雾,并带有刺激性气味的气体产生.实验室合成原理:SO2+Cl2+SCl2=2SOCl2,部分装置如图所示,回答以下问题:| 方案 | 甲 | 乙 | 丙 | 丁 |
| 发生装置 | 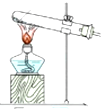 |  | 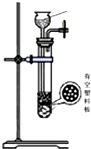 | 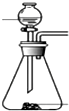 |
| 所选试剂 | NaHSO3固体 | 18.4mol/LH2SO4+Cu | 4mol/LHNO3+Na2SO | 70%H2SO4+K2SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
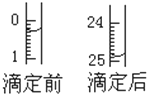 某学生用0.1mol•L-1的KOH标准溶液滴定未知浓度的盐酸,其操作分解为如下几步:
某学生用0.1mol•L-1的KOH标准溶液滴定未知浓度的盐酸,其操作分解为如下几步:| 滴定序号 | 待测液体积(mL) | 所消耗KOH标准液的体积(mL) | ||
| 滴定前 | 滴定后 | 消耗的体积 | ||
| 1 | 20.00 | 0.50 | 25.12 | 24.62 |
| 2 | 20.00 | 0.30 | 24.90 | 24.60 |
| 3 | 20.00 | 6.00 | 30.58 | 24.58 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
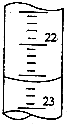 用中和滴定法测定烧碱的纯度,若烧碱中不含有与酸反应的杂质,试根据实验回答:
用中和滴定法测定烧碱的纯度,若烧碱中不含有与酸反应的杂质,试根据实验回答:| 滴定次数 | 待测液体积/mL | 标准盐酸体积/mL | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
| 第三次 | 10.00 | 4.20 | 25.70 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com