
| 实验序号 | I | II | III |
| 盐酸体积(mL) | 50.0 | 50.0 | 50.0 |
| 样品质量/g | 9.2 | 15.7 | 27.6 |
| CO2体积/L (标准状况) | 2.24 | 3.36 | 3.36 |
分析 混合物发生反应:H++HCO3-═CO2↑+H2O,由①②数据可知,继续增大混合物的质量,气体的体积增大,说明实验①中盐酸有剩余、固体混合物完全反应.若②中盐酸有剩余,继续增大混合物的质量,气体的体积会增大,由②③数据可知,实验中气体的体积不变,说明实验②中盐酸完全反应,根据实验①的数据可知,生成3.36L二氧化碳需要固体混合物的质量为9.2g×$\frac{3.36L}{2.24L}$=13.8 g<16.56g,故实验②中盐酸完全反应、固体混合物有剩余,据此解答.
解答 解:(1)求盐酸浓度需选择盐酸不足量的数据进行,如随着混合物质量增加,二氧化碳气体量不再增加,表明盐酸全部反应完,由表中数据可知,盐酸完全反应生成二氧化碳3.36L,结合H++HCO-3=H2O+CO2↑可知n(HCl)=$\frac{3.36L}{22.4L/mol}$=0.15mol,盐酸的浓度为$\frac{0.15mol}{0.05L}$=3mol/L,故答案为:3.0mol/L;
(2)加入9.2g混合物时,盐酸有剩余,混合物完全反应,根据H++HCO3-═CO2↑+H2O,可知n(混合物)=n(CO2)=0.1mol,
设9.2 g混合物中NaHCO3、KHCO3的物质的量分别为x和y,
则有:x+y=0.1mol、84x+100y=9.2g,
解之得:$\left\{\begin{array}{l}{x=0.05mol}\\{y=0.05mol}\end{array}\right.$,所以27.6g混合物中NaHCO3的物质的量是$\frac{27.6}{9.2}$=0.15mol,所以碳酸氢钾的物质的量为0.15mol,而生成二氧碳的物质的量为:$\frac{3.36}{22.4}$=0.15mol,所以消耗碳酸氢钠和碳酸氢钾各一半,则剰余NaHCO3的物质的量为$\frac{0.15mol}{2}$=0.075mol,故答案为:0.075mol.
点评 本题考查混合物的有关计算,根据二氧化碳的体积变化判断盐酸是否完全反应式是关键,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 测得0.10mol/LCH3COOH溶液中存在较多的CH3COOH分子 | |
| B. | 比较等浓度等体积的盐酸、CH3COOH溶液与足量Zn反应生成H2的体积 | |
| C. | 比较等浓度等体积的盐酸、CH3COOH溶液与等量NaOH溶液反应后放出的热量 | |
| D. | 0.10mol/LNH4Cl呈酸性,0.1mol/LCH3COONH4溶液呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验方案 |
| ① | 检验淀粉是否水解生成葡萄糖 | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后新制Cu(OH)2浊液,加热,观察是否有红色沉淀生成 |
| ② | 比较H2CO3,HCN的酸性强弱 | 用pH计测定同温度同浓度的Na2CO3溶液和NaCN溶液的pH,比较pH大小 |
| ③ | 区别植物油和矿物油 | 向植物油和矿物油中分别加入烧碱溶液,加热,冷却后观察是否分层 |
| ④ | 验证CaCO3的溶解度小于CaSO4 | 将浓Na2CO3溶液滴加到CaSO4悬浊液中,充分振荡,过滤、洗涤,向所得固体中滴加盐酸,观察是否有气体生成 |
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 至少存在5种离子 | |
| B. | C1-一定存在,且c Cl-)≥0.4mol/L | |
| C. | SO42-、NH4+一定存在,CO32-可能存在 | |
| D. | CO32-、Al3+一定不存在,K+一定存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
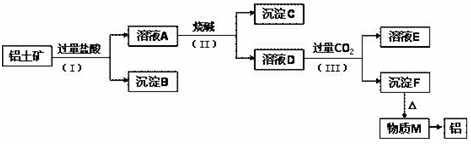
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③①④⑤ | B. | ①②③⑤④ | C. | ③②①⑤④ | D. | ③⑤②①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
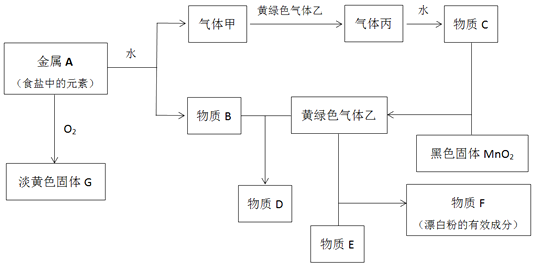
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
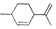 的化合物,则下列有关它的推断错误的是( )
的化合物,则下列有关它的推断错误的是( )| A. | 分子式为C10H16 | B. | 其一氯代物有9种 | ||
| C. | 常温下呈固态,比水重 | D. | 能与溴水发生加成反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com