
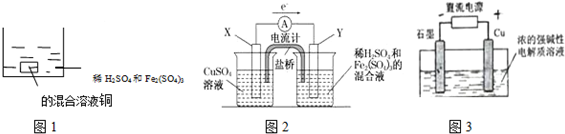
| A. | 如图1 所示将一定量的铜片加入到100 mL 稀硫酸和硫酸铁的混合溶液中,若铜片完全溶解时(不考虑盐的水解及溶液体积的变化),溶液中的Fe3+、Cu2+、H+三种离子的物质的量浓度相等,且测得溶液的pH=1,则溶液中c(SO42-)为0.5mol/L | |
| B. | 如图2 所示的装置中发生Cu+2Fe3+═Cu2++2Fe2+的反应,X 极是负极,Y 极的材料名称可以是铜 | |
| C. | Cu2O 是一种半导体材料,基于绿色化学理念设计的制取.Cu2O 的电解池示意图如图3所示,石墨电极上产生氢气,铜电极发生还原反应 | |
| D. | 如图3 所示当有0.1mol 电子转移时,有0.1molCu2O 生成 |
分析 A.根据溶液中的电荷守恒计算;
B.由电子转移方向可知X为负极,Y为正极,负极应为Cu;
C.Cu被氧化生成Cu2O,应为电解池的阳极反应;
D.根据电极方程式2Cu-2e-+2OH-=Cu2O+H2O计算.
解答 解:A.溶液的pH=1,则c(H+)=0.1mol/L,由电荷守恒可知:3c(Fe3+)+2c(Cu2+)+c(H+)+2c(Fe2+)=2c(SO42-),且溶液中的Fe3+、Cu2+、H+三种离子的物质的量浓度相等,由Cu+2Fe3+═Cu2++2Fe2+可知,c(Fe2+)=0.2mol/L,可解得:c(SO42-)=0.5mol/L,故A正确;
B.由电子转移方向可知X为负极,Y为正极,负极应为Cu,Y极的材料可以活泼性比铜弱的金属或非金属,故B错误;
C.Cu被氧化生成Cu2O,应为电解池的阳极反应,发生氧化反应,故C错误;
D.电极方程式为2Cu-2e-+2OH-=Cu2O+H2O,当有0.1mol电子转移时,有0.05mol Cu2O生成,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,侧重于学生的分析能力、计算能力的考查,注意把握电极方程式的书写,易错点为A,注意从电荷守恒的角度解答,难度中等.


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 加入金属镁产生H2的溶液中:NH4+、Na+、SO42-、CH3COO- | |
| B. | 含有大量ClO-的溶液中:K+、Na+、NO3-、SO42- | |
| C. | c(Cu2+)=0.1 mol•L-1的溶液中:H+、NH4+、Br-、CO32- | |
| D. | 含有大量MnO4-的溶液中:H+、SO42-、Cl-、CH3CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中一定含有离子键 | |
| B. | 有机聚合高分子中只含有单键 | |
| C. | 乙醇、乙醛和乙酸互为同分异构体 | |
| D. | 纤维素属于天然高分子化合物,分子中含有碳氢两种元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①③⑤ | C. | ②③⑤ | D. | ②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 聚四氟乙烯有固定的熔点 | |
| B. | 合成ETFE及合成聚全氟乙丙烯的反应均为加聚反应 | |
| C. | 聚全氟乙丙烯分子的结构简式可能为 | |
| D. | ETFE分子中可能存在“-CH2-CH2-CF2-CF2-”的连接方式 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 若c1=2c2,则w1<2w2,V<100mL | B. | 若c1=2c2,则w1>2w2,V>100mL | ||
| C. | 若w1=2w2,则c1>2c2,V=100mL | D. | 若w1=2w2,则c1>2c2,V<100mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径由小到大的顺序:X<Y<Z<W | |
| B. | Z的最高价氧化物能与水反应生成相应的酸 | |
| C. | 室温下,0.1 mol/L W的气态氢化物的水溶液的pH>1 | |
| D. | Y单质在一定条件下可以与氧化铁发生置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 湿法炼铜和火法炼铜的反应中,铜元素都发生还原反应 | |
| B. | 加强热,使CuO在高温条件下分解制备单质Cu | |
| C. | 黑色金属材料包括铁、铬、锰及其化合物 | |
| D. | 生铁与钢的区别在于生铁含碳杂质,而钢不含 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com