
【题目】化合物H是一种香料,存在于金橘中,可用如下路线合成: 
已知:R﹣CH=CH2 ![]() R﹣CH2CH2OH(B2H6为乙硼烷)
R﹣CH2CH2OH(B2H6为乙硼烷)
回答下列问题:
(1)11.2L(标准状况)的烃A在氧气中充分燃烧可以产生88g CO2和45g H2O.A的分子式是
(2)B和C均为一氯代烃,它们的名称(系统命名)分别为
(3)在催化剂存在下1mol F与2mol H2反应,生成3﹣苯基﹣1﹣丙醇.F的结构简式是
(4)反应①的反应类型是;
(5)反应②的化学方程式为
(6)写出所有与G具有相同官能团的G的芳香类同分异构体的结构简式: .
【答案】
(1)C4H10
(2)2﹣甲基﹣1﹣氯丙烷和2﹣甲基﹣2﹣氯丙烷
(3)
(4)消去反应
(5)
(6) 、
、  、
、  、
、 
【解析】解:(1.)88gCO2为2mol,45gH2O为2.5mol,标准11.2L,即为0.5mol,所以烃A中含碳原子为4,H原子数为10,则化学式为C4H10 , 所以答案是:C4H10;
(2.)根据上面的分析可知,它们的名称(系统命名)分别为2﹣甲基﹣1﹣氯丙烷和2﹣甲基﹣2﹣氯丙烷,所以答案是:2﹣甲基﹣1﹣氯丙烷和2﹣甲基﹣2﹣氯丙烷;
(3.)F可以与Cu(OH)2反应,故应为醛基,与H2之间为1:2加成,则应含有碳碳双键.从生成的产物3﹣苯基﹣1﹣丙醇分析,F的结构简式为  ,
,
所以答案是:  ;
;
(4.)反应①为卤代烃在醇溶液中的消去反应,所以答案是:消去反应;
(5.)F被新制的Cu(OH)2氧化成羧酸G为  ,D至E为信息相同的条件,则类比可不难得出E的结构为
,D至E为信息相同的条件,则类比可不难得出E的结构为 ![]() ,E与G在浓硫酸作用下可以发生酯化反应,反应方程式为:
,E与G在浓硫酸作用下可以发生酯化反应,反应方程式为:  ,
,
所以答案是:  ;
;
(6.)G中含有官能团有碳碳双键和羧基,可以将官能团作相应的位置变换而得出其芳香类的同分异构体为  、
、  、
、 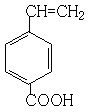 、
、 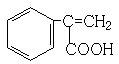 ,
,
所以答案是: 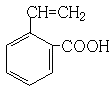 、
、  、
、  、
、 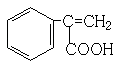 .
.


科目:高中化学 来源: 题型:
【题目】已知:2X(g)+Y(g)a Z(g),在T1温度下,体积为2L的密闭容器中,充入6mol X和2mol Y.根据图示回答: 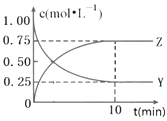
(1)a=;用Y的浓度变化表示从反应开始到平衡时的平均反应速率为mol/(Lmin).
(2)平衡时,Y在混合物中的物质的量分数是
(3)其他条件不变时,下列措施可以提高Y的转化率的是(选填字母).
A.使用适当的催化剂
B.分离出Z
C.增大容器体积.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列各物质的化学式
①五个亚铁离子______________②氢氧化钠______________③硝酸_____________④硫酸铝_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如下图所示。已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O=O为500、N—N为154,则断裂1 mol N—H键所需的能量(kJ)是:
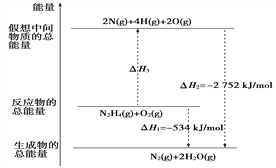
A. 194 B. 391 C. 516 D. 658
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某有机物分子的简易球棍模型,该有机物中含C,H,O,N四种元素.下列关于该有机物的说法中错误的是( ) 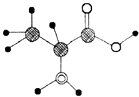
A.分子式为C3H7O2N
B.能发生取代反应
C.能通过聚合反应生成高分子化合物
D.该有机物能跟NaOH溶液反应,但不能和盐酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.7g铝溶解于100mL3mol/LNaOH溶液中,然后向所得溶液中加入400mL,1mol/L的盐酸,最后可得沉淀的质量是( )
A.2.7g
B.5.2g
C.7.8g
D.10g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上设计用CO2来生产燃料甲醇,既减少二氧化碳气体,又得到宝贵的能源物质.为了探究反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1molCO2和3molH2 , 某温度下发生反应:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=﹣49.0KJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示
(1)该反应该温度下,化学平衡常数的值为
(2)下列说法中能作为反应达到平衡状态标志的是(填字母).
A.容器内压强不再发生变化
B.平均相对分子质量不再变化
C.c(CO2)和c(H2)之比等于1:3
D.相同时间内每断裂3molH﹣H键,同时断裂3molO﹣H键
(3)下列措施中能使 ![]() 减小的是
减小的是
A.再充入1molCO2和3molH2
B.将H2O(g)从体系中分离
C.充入He(g),使体系压强增大
D.升高温度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容下,向2L密闭容器中加入MgSO4(s)和CO(g),发生反应:MgSO4(s)+CO(g)MgO(s)+CO2(g)+SO2(g).反应过程中测定的部分数据如表:
反应时间/min | n(MgSO4)/mol | n(CO)/mol | n(SO2)/mol |
0 | 2.0 | 2.0 | 0 |
2 | 0.8 | ||
4 | 1.2 | ||
6 | 1.2 | 2.8 |
下列说法正确的是( )
A.0~2 min内的平均速率为υ (CO)=0.6 mol/(Lmin)
B.4 min后,平衡移动的原因可能是向容器中加入了2.0 mol的SO2
C.若升高温度,反应的平衡常数变为1.0,则正反应为放热反应
D.其他条件不变,若起始时容器中MgSO4、CO均为1.0 mol,则平衡时n(SO2)=0.6 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com