
分析 (1)A.亚硝酸钠是强碱弱酸盐其水溶液呈碱性,氯化钠是强酸强碱盐其水溶液呈中性;
B.亚硝酸根离子不和银离子反应,氯离子和银离子反应生成白色沉淀;
C.酸性条件下,亚硝酸根离子能被碘离子还原生成一氧化氮,同时生成碘单质;
D.甲基橙的变色范围是3.1-4.4;
(2)由亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒,可知维生素C将铁离子还原;
(3)Cl2、HNO3都能氧化亚铁离子,但能引入新的杂质,铁不能氧化亚铁离子,双氧水的还原产物是水,不引入杂质;
(4)把酸性高锰酸钾溶液滴入到NaNO2溶液中,观察到紫色褪色,同时生成NO3-和Mn2+,二者发生氧化还原反应;
(5)高铁酸钾具有氧化性可以消毒杀菌,在水中被还原为三价铁离子,三价铁离子水解生成氢氧化铁胶体具有吸附悬浮杂质的作用,结合电子、原子守恒配平反应.
解答 解:(1)A.亚硝酸钠是强碱弱酸盐其水溶液呈碱性,氯化钠是强酸强碱盐其水溶液呈中性,相同物质的量浓度的两种溶液的pH不同,所以可以用测定这两种溶液的pH值鉴别,故A不选;
B.亚硝酸根离子不和银离子反应,氯离子和银离子反应生成不溶于硝酸的白色沉淀,反应现象不同,所以可以用AgNO3和HNO3两种试剂来区别,故B不选;
C.在酸性条件下,亚硝酸钠和碘离子反应方程式为2NO2-+2I-+4H+=2NO↑+I2+2H2O,碘遇淀粉变蓝色,氯离子和碘离子不反应,所以反应现象不同,所以可以用酸性条件下的KI淀粉试液来区别,故C不选;
D.亚硝酸钠是强碱弱酸盐其水溶液呈碱性,氯化钠是强酸强碱盐其水溶液呈中性,甲基橙的变色范围是3.1-4.4,所以亚硝酸钠和氯化钠溶液加入甲基橙后溶液都呈黄色,反应现象相同,所以不能用甲基橙鉴别,故D选;
故答案为:D;
(2)A.亚硝酸盐具有氧化性,氧化亚铁离子,本身被还原,故A正确;
B.维生素C可将铁离子转化为亚铁离子,具有还原性,是还原剂,故B正确;
C.由信息可知维生素C将Fe3+还原为Fe2+,故C正确;
D.亚硝酸盐具有氧化性,亚硝酸盐是氧化剂,故D错误;
故答案为:D;
(3)由于KMnO4、Cl2、HNO3都能氧化亚铁离子,但能引入新的杂质,铁不能氧化亚铁离子,双氧水的还原产物是水,不引入杂质,所以正确是双氧水,
故答案为:B;
(4)酸性高锰酸钾溶液滴入到NaNO2溶液中,观察到紫色褪色,同时生成NO3-和Mn2+,反应的离子方程式为:6H++5NO2-+2MnO4-═NO3-+2Mn2++3H2O;
故答案为:6H++5NO2-+2MnO4-═NO3-+2Mn2++3H2O;
(5)高铁酸钾( K2FeO4)中Fe的化合价是+6价,具有强氧化性,能杀菌消毒,其还原产物Fe3+水解生成氢氧化铁胶体,能吸附水中杂质,所以高铁酸钾作为水处理剂发挥的作用是净水、消毒;若FeSO4和O2的化学计量数比为2:1,由电子及原子守恒可知反应为2FeSO4+6K2O2=2K2FeO4+2K2O+2K2SO4+O2↑,
故答案为:净水、消毒;2FeSO4+6K2O2=2K2FeO4+2K2O+2K2SO4+O2↑.
点评 本题考查物质的鉴别及检验、氧化还原反应等,为高频考点,把握物质的性质、发生的反应、性质与用途等为解答的关键,侧重分析与应用能力的考查,题目难度中等.


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
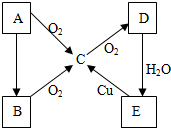 A、B、C、D、E五种物质在一定条件下的转化关系如图所示.
A、B、C、D、E五种物质在一定条件下的转化关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含氢量:苯>乙烯>甲烷 | |
| B. | 密度:H 2O>溴苯>苯 | |
| C. | 沸点:戊烷>2-甲基丁烷>2,2-二甲基丙烷 | |
| D. | 等质量的下列物质燃烧耗O 2量:乙炔>乙烯>乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 分子中至少有8个碳原子处于同一平面上 | |
| B. | 分子中至少有9个碳原子处于同一平面上 | |
| C. | 该烃的一氯取代物最多有8种 | |
| D. | 分子中至少有6个碳原子处于同一直线上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴水中有下列平衡:Br2+H2O?HBr+HBrO当加入AgNO3(s)后溶液颜色变浅 | |
| B. | 2NO2(g)?N2O4(g)△H<0,升高温度可使体系颜色加深 | |
| C. | 反应N2+3H2?2NH3△H<0,增大压强可提高N2的转化率 | |
| D. | 合成氨反应CO+NO2?CO2+NO△H>0中使用催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
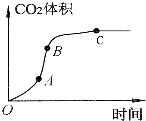 某学生用优质大理石与稀盐酸反应制取CO2,(不考虑反应过程中溶液体积的变化),实验结果如图所示,下列说法错误的是( )
某学生用优质大理石与稀盐酸反应制取CO2,(不考虑反应过程中溶液体积的变化),实验结果如图所示,下列说法错误的是( )| A. | AB段反应速率最快的原因可能是反应放热,体系温度升高 | |
| B. | BC段反应速率变慢的原因可能是盐酸浓度降低 | |
| C. | 该反应速率也可以用CaCl2的浓度变化与时间关系来表示 | |
| D. | C点后CO2体积不变的原因一定是大理石消耗完 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图曲线a表示可逆反应X(g)+Y(g)?Z(g)+M(g).进行过程中Z的物质的量随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
如图曲线a表示可逆反应X(g)+Y(g)?Z(g)+M(g).进行过程中Z的物质的量随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )| A. | 压缩反应容器的体积 | B. | 加入一定量的Z | ||
| C. | 降低温度 | D. | 减少X的投入量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com