
| 温度/℃ | 250 | 310 | 350 |
| K/(mol•L-1)-2 | 2.041 | 0.250 | 0.012 |
| 浓度mol•L-1 时间/min | C(CO) | C(H2) | C(CH3OH) |
| 0 | 0.8 | 1.6 | 0 |
| 2 | 0.6 | x | 0.2 |
| 4 | 0.3 | 0.6 | 0.5 |
| 6 | 0.3 | 0.6 | 0.5 |
分析 (1)升高温度,平衡向吸热反应方向移动,升高温度平衡常数减小,平衡向逆反应方向移动,则正反应是放热反应;
(2)平衡时,c(CO)=0.5mol•L-1,则平衡时n(CO)=0.5mol/L×2L=1mol,则参加反应的n(CO)=(2-1)mol=1mol,根据方程式知,参加反应的n(H2)=2n(CO)=2mol,生成n(CH30H)=n(CO)=1mol,平衡时c(H2)=$\frac{6-2}{2}$mol/L=2mol/L、c(CH30H)=$\frac{1mol}{2L}$=0.5mol/L,浓度商=$\frac{0.5}{0.5×{2}^{2}}$=0.25,根据化学平衡常数确定温度;
(3)①2-4min内v(CO)=$\frac{0.6-0.3}{4-2}$ mol•L-1 min-1=0.15 mol•L-1 min-1,再根据同一反应中同一时间段内各物质的反应速率之比等于计量数之比计算氢气反应速率;
②反应达到平衡状态时,CO转化率=$\frac{0.8-0.3}{0.8}$×100%;
③0-2min内,CO物质的量浓度减少(0.8-0.6)mol/L=0.2mol/L、2-4min内CO物质的量浓度减少(0.6-0.3)mol/L=0.3mol/L,相同时间内随着反应的进行,CO的反应速率增大,改变的条件可能是温度、催化剂或CO浓度;
(4)将方程式$\frac{①-②}{2}+2③$得CH3OH(l)+O2(g)=CO(g)+2H2O(l),焓变进行相应的改变;
(5)甲醇燃料酸性电池中,负极上甲醇失电子和水反应生成二氧化碳和氢离子;根据转移电子相等计算生成氢气体积.
解答 解:(1)升高温度,平衡向吸热反应方向移动,升高温度平衡常数减小,平衡向逆反应方向移动,则正反应是放热反应,△H<0,故答案为:<;
(2)平衡时,c(CO)=0.5mol•L-1,则平衡时n(CO)=0.5mol/L×2L=1mol,则参加反应的n(CO)=(2-1)mol=1mol,根据方程式知,参加反应的n(H2)=2n(CO)=2mol,生成n(CH30H)=n(CO)=1mol,平衡时c(H2)=$\frac{6-2}{2}$mol/L=2mol/L、c(CH30H)=$\frac{1mol}{2L}$=0.5mol/L,浓度商=$\frac{0.5}{0.5×{2}^{2}}$=0.25,根据表中数据知,该温度是310℃,故答案为:310;
(3)①2-4min内v(CO)=$\frac{0.6-0.3}{4-2}$ mol•L-1 min-1=0.15 mol•L-1 min-1,再根据同一反应中同一时间段内各物质的反应速率之比等于计量数之比计算氢气反应速率为0.3mol•L-1 min-1,故答案为:0.3mol•L-1 min-1;
②反应达到平衡状态时,CO转化率=$\frac{0.8-0.3}{0.8}$×100%=62.5%,故答案为:62.5%;
③0-2min内,CO物质的量浓度减少(0.8-0.6)mol/L=0.2mol/L、2-4min内CO物质的量浓度减少(0.6-0.3)mol/L=0.3mol/L,相同时间内随着反应的进行,CO的反应速率增大,改变的条件可能是温度、催化剂或CO浓度,故选a;
(4)将方程式$\frac{①-②}{2}+2③$得CH3OH(l)+O2(g)=CO(g)+2H2O(l),△H=$\frac{-1275.6-(-566.0)}{2}kJ/mol+2(-44.0kJ/mol)$=-442.8kJ•mol-1,
故答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ•mol-1;
(5)甲醇燃料酸性电池中,负极上甲醇失电子和水反应生成二氧化碳和氢离子,电极反应式为CH3OH+H2O=CO2+6H++6e-;32g甲醇的物质的量=$\frac{32g}{32g/mol}$=1mol,1mol甲醇反应失去6mol电子,
根据转移电子相等计算生成氢气体积=$\frac{6mol}{2}×22.4L/mol$=67.2L.
故答案为:CH3OH+H2O=CO2+6H++6e-;67.2.
点评 本题考查化学平衡有关计算、原电池原理、化学平衡影响因素等知识点,为高频考点,明确平衡影响因素原理、原电池原理是解本题关键,难点是电极反应式的书写,注意结合溶液酸碱性书写,题目难度不大.


科目:高中化学 来源: 题型:填空题
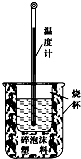 实验室利用如图装置进行中和热的测定.回答下列问题:
实验室利用如图装置进行中和热的测定.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是元素周期表中几种短周期主族元素原子半径随原子序数的变化.
如图是元素周期表中几种短周期主族元素原子半径随原子序数的变化.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 +(CH3)3CCl $\stackrel{无水AlCl_{3}}{→}$
+(CH3)3CCl $\stackrel{无水AlCl_{3}}{→}$ +HCl.
+HCl.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .元素⑩名称为溴在周期表中的位置第四周期第ⅦA族.
.元素⑩名称为溴在周期表中的位置第四周期第ⅦA族. .
. ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物. ,该化合物是由极性(填“极性”、“非极性”)键形成的.
,该化合物是由极性(填“极性”、“非极性”)键形成的.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2或N2O4的浓度不再变化 | B. | c(NO2)=c(N2O4) | ||
| C. | v正(NO2)=v逆(N2O4) | D. | NO2、N2O4的总质量不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl-的结构示意图: | |
| B. | 硝基苯的结构简式: | |
| C. | 乙烯的结构式: | |
| D. | 氢元素有三种核素:${\;}_{1}^{1}H$、${\;}_{1}^{2}$D、${\;}_{1}^{3}$T |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com