
【题目】现有常温下的六种溶液:①0.01mol·L-1CH3COOH溶液;②0.01mol·L-1HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液;⑤0.01mol·L-1CH3COOH溶液与pH=12的氨水等体积混合后所得溶液;⑥0.01mol·L-1HCl溶液与pH=12的NaOH溶液等体积混合所得溶液。
(1)将②③混合后所得溶液pH=7,则消耗溶液的体积:②__(填“>”“<”或“=”)③。
(2)若将②③等体积混合后,则所得混合溶液中各离子浓度大小顺序为__。
(3)将六种溶液稀释100倍后,比较溶液的pH:③__(填“>”“<”或“=”)④。
(4)水的电离程度相同的是__(填序号)。
(5)将①④混合,若有c(CH3COO-)>c(Na+),则混合液呈_(填字母)。
A.酸性 B.碱性 C.中性 D.三性皆有可能
(6)若改变温度后,测得④溶液pH=10,则该温度下Kw=__。在该温度下,将①④混合后,测得溶液pH=7,则所得溶液中c(Na+)-c(CH3COO-)=__mol·L-1。
【答案】> c(NH4+)>c(Cl-)>c(OH-)>c(H+) > ②③④ A 10-12 (10-5-10-7)或9.9×10-6
【解析】
(1)②0.01mol/LHCl溶液中pH=2,③pH=12的氨水中氨水浓度大于0.01mol/L,等体积混合,氨水过量,氨水继续电离,溶液显碱性,据此分析判断;
(2)②0.01mol/LHCl溶液中pH=2,③pH=12的氨水中氨水浓度大于0.01mol/L,等体积混合,氨水过量,氨水继续电离,溶液呈碱性,据此分析排序;
(3)加水稀释促进弱电解质的电离,③④中氢氧根离子浓度相等,加水稀释促进一水合氨电离,导致③中氢氧根离子浓度大于④,据此判断;
(4)酸或碱抑制水的电离,含有弱根离子的盐促进水的电离,①②③④⑤抑制水的电离,⑥既不促进水的电离也不抑制水的电离;酸中氢离子浓度和碱中氢氧根离子浓度相等时,水的电离程度相同,据此分析判断;
(5)将①、④混合,若有c(CH3COO-)>c(Na+),根据电荷守恒分析判断;
(6)常温下,④pH=12的NaOH溶液,c(OH-)=10-2mol/L,改变温度后,pH=10,c(H+)=10-10,结合Kw=c(OH-)c(H+)计算;在该温度下,pH=7,溶液显碱性,根据电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),则所得溶液中c(Na+)-c(CH3COO-)=c(OH-)-c(H+)据此计算。
①0.01mol/LCH3COOH溶液中pH大于2;
②0.01mol/LHCl溶液中pH=2;
③pH=12的氨水中氨水浓度大于0.01mol/L;
④pH=12的NaOH溶液中氢氧化钠浓度等于0.01mol/L;
⑤0.01mol/LCH3COOH溶液与pH=12的氨水等体积混合后所得溶液,氨水过量,溶液呈碱性;
⑥0.01mol/LHCl溶液与pH=12的NaOH溶液等体积混合所得溶液,二者恰好反应生成氯化钠,溶液呈中性。
(1)②0.01mol/LHCl溶液中pH=2,③pH=12的氨水中氨水浓度大于0.01mol/L,等体积混合,氨水过量,氨水继续电离,溶液显碱性,要使pH=7,则消耗的盐酸的体积较大,故答案为:>;
(2)②0.01mol/LHCl溶液中pH=2,③pH=12的氨水中氨水浓度大于0.01mol/L,等体积混合,氨水过量,氨水继续电离,溶液呈碱性,所得混合溶液中各离子浓度大小顺序为c(NH4+)>c(Cl-)>c(OH-)>c(H+),故答案为:c(NH4+)>c(Cl-)>c(OH-)>c(H+);
(3)将这几种溶液稀释100倍数时,加水稀释促进弱电解质的电离,③④中氢氧根离子浓度相等,加水稀释促进一水合氨电离,导致③中氢氧根离子浓度大于④,所以③的pH>④的pH,故答案为:>;
(4)酸或碱抑制水的电离,含有弱根离子的盐促进水的电离,①②③④⑤抑制水的电离,⑥既不促进水的电离也不抑制水的电离,所以水的电离程度最大的是⑥;酸中氢离子浓度和碱中氢氧根离子浓度相等时,水的电离程度相同,②的氢离子浓度和③④中氢氧根离子浓度相等,所以水的电离程度相同的是②③④,故答案为:②③④;
(5)将①、④混合,若有c(CH3COO-)>c(Na+),根据电荷守恒,则有c(OH-)<c(H+),混合溶液呈酸性,故答案为:A;
(6)常温下,④pH=12的NaOH溶液,c(OH-)=10-2mol/L,改变温度后,pH=10,则Kw=c(OH-)c(H+)=10-2×10-10=10-12;在该温度下,pH=7,溶液显碱性,根据电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),则所得溶液中c(Na+)-c(CH3COO-)=c(OH-)-c(H+)=![]() -10-7=10-5-10-7,故答案为:10-12;10-5-10-7。
-10-7=10-5-10-7,故答案为:10-12;10-5-10-7。


科目:高中化学 来源: 题型:
【题目】“84”消毒液的成分是NaClO,某化学研究性学习小组在实验室制备NaClO并探究其性质。该学习小组用如图装置进行实验(部分夹持装置略去),反应一段时间后,取C瓶中的溶液进行实验,测得溶液的pH=12。(查阅资料:饱和NaClO溶液pH为11)。回答下列问题:
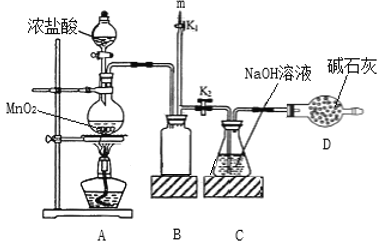
(1)装置A中发生反应的离子方程式为_______。
(2)实验结束后,在m处最好连接盛________(填“NaOH 溶液”或“水”) 的注射器,然后打开K1关闭K2,最后再拆除装置。
(3)测定C瓶溶液中NaClO含量的实验步骤如下:
步骤1:将C瓶溶液加入硫酸酸化,加入过量KI溶液,塞紧瓶塞并在暗处充分反应后滴入5~6滴淀粉溶液。
步骤2:分两次各取步骤1的溶液20mL于锥形瓶中,用0.1000mol·L-1 Na2S2O3 标准溶液滴定,滴定终点时两次耗Na2S2O3 溶液体积的平均值为16.00mL。(已知:I2+2S2O32- =2I-+S4O62-)
①步骤1的C瓶中发生反应的离子方程式为:______________________________。
②滴定终点的现象为__________________________________________________。
③C瓶溶液中NaClO含量为____________g·L-1。
④若盛Na2S2O3 标准溶液的滴定管未用Na2S2O3 标准溶液润洗,则测得C瓶溶液中NaClO含量__________(填“偏大”、“偏小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锡为ⅣA族元素,四碘化锡是常用的有机合成试剂(SnI4,熔点144.5℃,沸点364.5℃,易水解)。实验室以过量锡箔为原料通过反应Sn+2I2![]() SnI4制备SnI4。下列说法错误的是( )
SnI4制备SnI4。下列说法错误的是( )
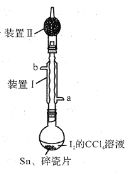
A. 加入碎瓷片的目的是防止暴沸
B. SnI4可溶于CCl4中
C. 装置Ⅰ中a为冷凝水进水口
D. 装置Ⅱ的主要作用是吸收挥发的I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热催化合成氨面临的两难问题是:采用高温增大反应速率的同时会因平衡限制导致NH3产率降低。我国科研人员研制了Ti-H-Fe双温区催化剂(Ti-H区域和Fe区域的温度差可超过100℃)。Ti-H-Fe双温区催化合成氨的反应历程如图所示,其中吸附在催化剂表面上的物种用*标注。下列说法正确的是( )
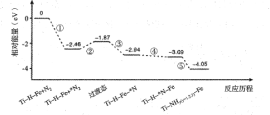
A. ①为N![]() N的断裂过程
N的断裂过程
B. ①②③在高温区发生,④⑤在低温区发生
C. ④为N原子由Fe区域向Ti-H区域的传递过程
D. 使用Ti-H-Fe双温区催化剂使合成氨反应转变为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非线性光学晶体在信息、激光技术、医疗、国防等领域具有重要应用价值。我国科学家利用CsCO3,XO2(X=Si、Ge)和H3BO3首次合成了组成为CsXB3O7,的非线性光学晶体。回答下列问题:
(1)C、O、Si三种元素电负性由大到小的顺序为__;第一电离能I1(Si)__I1(Ge)(填![]() 或
或![]() )。
)。
(2)基态Ge原子核外电子排布式为__;SiO2,GeO2具有类似的晶体结构,其中熔点较高的是__,原因是__。
(3)如图为H3BO3晶体的片层结构,其中B的杂化方式为__;硼酸在热水中比在冷水中溶解度显著增大的主要原因是__。

(4)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。CsSiB3O7,属正交晶系(长方体形),晶胞参数为apm、bpm和cpm。如图为沿y轴投影的晶胞中所有Cs原子的分布图和原子分数坐标。据此推断该晶胞中Cs原子的数目为__;CsSiB3O7的摩尔质量为Mg·mol-1,设NA为阿伏加德罗常数的值,则CsSiB3O7晶体的密度为__g·cm-3(用代数式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝热反应可用于焊接钢轨,反应为:2Al + Fe2O3 ![]() 2Fe + Al2O3,下列关于该反应说法正确的是
2Fe + Al2O3,下列关于该反应说法正确的是
A. Al 是还原剂 B. Fe2O3 发生氧化反应
C. Fe 是氧化产物 D. 当生成 1 mol Fe 时,转移 6 mol 电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁是由H+、Na+、Al3+、Ba2+、OH-、Cl-、HCO3-离子中的两种组成的溶液,可以发生如图转化,下列说法正确的是

A. 甲为HCl,乙为NaHCO3
B. 溶液丙中还可以大量共存的离子有:Fe2+、NO3-、SO42-
C. 在甲中滴加丁开始反应的离子方程式:HCO3-+Ba2++OH-=BaCO3↓+H2O
D. 白色沉淀A可能溶解在溶液D中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃、101kPa时,有以下能量转化图,下列说法不正确的是( )
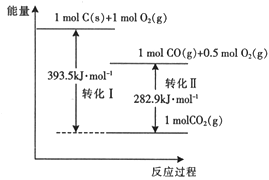
A. 转化Ⅱ的热化学方程式2CO(g)+O2(g)=2CO2(g) △H=-282.9 kJ·mol-1
B. 相同条件下,1mol C(s )和0.5 mol O2(g)总能量高于1mol CO(g)的能量
C. 由C→CO 的热化学方程式2C(s)+O2(g)=2CO(g) △H=-221.2 kJ·mol-1
D. CO2(g)分解为C(s)和O2(g)是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组对液态有机物M进行如下探究实验。请回答:
Ⅰ.M组成的探究
取6.2 g有机物M在足量O2中完全燃烧后,将生成 物全部通入如图1所示装置(夹持装置略去),则:
(1)若不考虑尾气处理,该装置还有一个明显不足为____________________________。
(2)若不考虑其他因素,且生成物在A、B中全部被吸收,测得装置A增重5.4 g,装置B增重8.8 g,M的实验式为___________________,分子式为_______________________。
Ⅱ.M结构的探究
为确定M的官能团,该小组设计如图2所示装置(加持装置略)进行实验,步骤为:
①准确量取2.79 mL ρ=1.11 g·mL-1的M加入分液漏斗中;
②打开分液漏斗活塞,当M恰好全部加入a中时,迅速关闭分液漏斗活塞;
③a中反应完全后,准确读取量筒中液体体积。
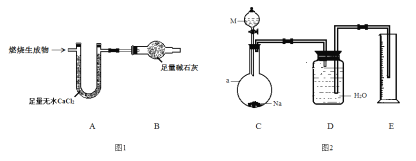
(3)a仪器的名称为__________;伸入量筒中的导管 ____(填“长”或“短”)些更合理。
(4)实验前,检验C、D部分装置气密性的方法为____________________________。
(5)第③步中,准确读取量筒读数,注意的事项为冷至室温、__________________和_____________________________。
(6)下列各项,可能导致所测气体体积偏大的为__________(填选项字母)。
A.所取M中含有少量水
B.装置C中Na过量
C.装置D、E间导管中的水没有排入量筒中
D.分液漏斗中液体M加入仪器a,将a中部分气体排入D
(7)若量筒中水的体积转化为标准状况下气体体积为560 mL,装置C中反应的化学方程式为______________________________________________(有机物用结构简式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com