
下列关于钠和钠的化合物的叙述不正确的是( )
A. 热稳定性:Na2CO3>NaHCO3
B.Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物
C.碳酸氢钠可用于治疗胃酸过多
D.Na2O2中阴、阳离子的个数比为1∶ 2
科目:高中化学 来源: 题型:
大气中的部分源于O3对海水中I-的氧化。将O3持续通入NaI溶液中进行模拟研究。
(1)O3将I-氧化成I2的过程由3步反应组成:
①I-(aq)+O3(g)===IO-(aq)+O2(g) ΔH1;
②IO-(aq)+H+(aq)  HOI(aq) ΔH2;
HOI(aq) ΔH2;
③HOI(aq)+I-(aq)+H+(aq)  I2(aq)+H2O(l) ΔH3。
I2(aq)+H2O(l) ΔH3。
总反应的化学方程式为______________________________________________________,其反应热ΔH=________。
(2)在溶液中存在化学平衡:I2(aq)+I-(aq)  I
I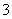 (aq),其平衡常数表达式为______________。
(aq),其平衡常数表达式为______________。
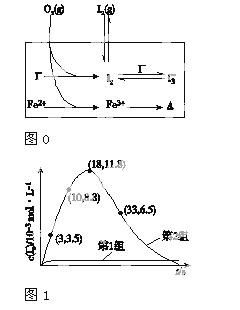
(3)为探究Fe2+对O3氧化I-反应的影响(反应体系如图0),某研究小组测定两组实验中I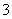 浓度和体系pH,结果见图1和下表。
浓度和体系pH,结果见图1和下表。
| 编号 | 反应物 | 反应前pH | 反应后pH |
| 第1组 | O3+I- | 5.2 | 11.0 |
| 第2组 | O3+I-+Fe2+ | 5.2 | 4.1 |
①第1组实验中,导致反应后pH升高的原因是__________________________________
________________________________________________________________________。
②图中的A为________。由Fe3+生成A的过程能显著提高I-的转化率,原因是
________________________________________________________________________
________________________________________________________________________。
③第2组实验进行18 s后,I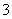 浓度下降。导致下降的直接原因有(双选)________。
浓度下降。导致下降的直接原因有(双选)________。
A.c(H+)减小 B.c(I-)减小
C.I2(g)不断生成 D.c(Fe3+)增加
(4)据图1,计算3~18 s内第2组实验中生成I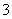 的平均反应速率(写出计算过程,结果保留两位有效数字)。
的平均反应速率(写出计算过程,结果保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列操作或发生事故时的处理方法正确的是( )
|
| A. | 将pH试纸用蒸馏水润湿后,测定稀盐酸的pH值 |
|
| B. | 给试管里的液体加热时,试管应与桌面垂直 |
|
| C. | 配制一定浓度的NaCl溶液时,定容振荡摇匀后,发现液面低于刻度线,再加水到刻度线 |
|
| D. | 浓硫酸不慎沾在皮肤上,应立即用干布拭去,然后用水冲洗,最后再涂上3%~5%的小苏打溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
1)浓硫酸与木炭粉在加热条件下反应的化学方程式是: .
(2)试用下图所列各装置设计一个实验,来验证上述反应所产生的各种产物.
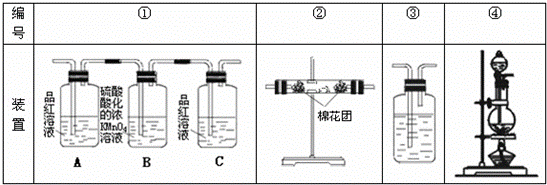
这些装置的连接顺序(按产物气流从左至右的方向)是(填装置的编号): → → → .
(3)实验时可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色.A瓶溶液的作用是 ,B瓶溶液的作用是 ,C瓶溶液的作用是 .
(4)装置②中所加固体药品是 ,可验证的产物是 ,确定装置②在整套装置中位置的理由是 .
(5)装置③中所盛溶液是 ,可验证的产物是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏伽德罗常数的值,下列说法正确的是 ( )
A.0.1molN2与0.3molH2在密闭容器催化剂作用下充分反应,生成氨分子数为0.2NA
B.标准状况下,11.2L甲醛气体中电子数为8NA
C.常温常压下,7.8g苯中含有单键的数目为0.9NA
D.1L浓度为1mol·L-1的Na2CO3溶液中含有NA个CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
有如下反应2SO2(g)+ O2(g)  2SO3(g),△H=—197KJ/mol,同温下,往体积相同的密闭容器A、B中分别充入2molSO2、1mol O2和1mol SO2、0.5mol O2,当它们分别达到平衡时放出的热量为Q1KJ和Q2 KJ,则下列比较正确的是( )
2SO3(g),△H=—197KJ/mol,同温下,往体积相同的密闭容器A、B中分别充入2molSO2、1mol O2和1mol SO2、0.5mol O2,当它们分别达到平衡时放出的热量为Q1KJ和Q2 KJ,则下列比较正确的是( )
A. Q1=2Q2=197KJ B. Q1=2Q2〈197KJ
C.2Q2〈Q1〈197KJ D.Q1〈2Q2〈197KJ
查看答案和解析>>
科目:高中化学 来源: 题型:
性质决定用途,化学知识运用得当可以使人类的生活更美好.下列物质性质与应用的对应关系正确的是( )
|
| A. | 晶体硅熔点高硬度大,可用于制作半导体材料 |
|
| B. | 浓硫酸具有酸性,可用于刻蚀玻璃制品 |
|
| C. | 漂白粉在空气中不稳定,可用于漂白纸张 |
|
| D. | 氢氧化铝具有弱碱性,可用于制胃酸中和剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
中学常见化学反应方程式为:A+B→X+Y+H2O(未配平,反应条件略去),其中,A、B的物质的量之比为1:4.请回答:
(1)若Y为黄绿色气体,该反应的离子方程式为 ,B体现出的化学性质有 .
(2)若A为常见的非金属单质,B的溶液为某浓酸,反应条件为加热,其反应的化学方程式为 .
(3)若A为某不活泼的金属单质,该反应能产生一种造成光化学烟雾的气体,该反应中氧化剂与还原剂的物质的量之比为
(4)若A为常见的金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中.写出A与X的溶液反应的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,通过下列反应可实现燃煤烟气中硫的回收:
SO2(g)+2CO(g) 2CO2(g)+s(l) △H<0
2CO2(g)+s(l) △H<0
若反应在恒容的密闭容器中进行,下列有关说法正确的是
A.平衡前,随着反应的进行,容器内压强始终不变
B.平衡时,其它条件不变,分享出硫,正反应速率加快
C.平衡时,其他条件不变,升高温度可提高 的转化率
的转化率
D.其它条件不变,使用不同催化剂,该反应的平衡常数不
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com