
科目:高中化学 来源: 题型:选择题
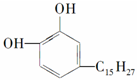 ②白藜芦醇
②白藜芦醇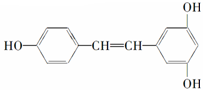
| A. | 2mol、6mol | B. | 5mol、6mol | C. | 4mol、5mol | D. | 3mol、6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
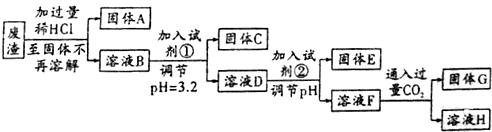
| 离子 | 以氢氧化物形式完全沉淀时所需pH | 氢氧化物沉淀完全溶解时所需pH |
| Fe3+ | 3.2 | |
| A13+ | 5.3 | 11.9 |
| Mg2+ | 12.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2晶体结构中,每个Si原子与2个O原子直接相连 | |
| B. | 通常状况下,60gSiO2晶体中含有的分子数为NA(NA表示阿伏加德罗常数) | |
| C. | 12g金刚石含4molC-C键 | |
| D. | 金刚石网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 辛烯和3-甲基-1-丁烯 | B. | 苯和乙炔 | ||
| C. | 2-甲基-3-乙基-1-戊烯和环丙烷 | D. | 软脂酸和硬脂酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
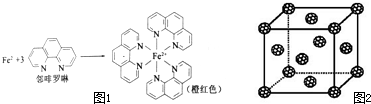
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
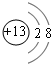 、
、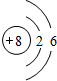 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | b=a+34 | B. | a=b-11 | C. | b=a+25 | D. | a=b-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;由A和B形成的原子个数为1:1的化合物中阴阳离子个数比为1:1.
;由A和B形成的原子个数为1:1的化合物中阴阳离子个数比为1:1.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com