
����Ŀ��T��ʱ����2L���ܱ������У�����X��Y��Z�����ʵ�����ʱ��ı仯������ͼ��ʾ��

��1���÷�Ӧ�Ļ�ѧ����ʽΪ_________________________.
��2��0~10s�ڣ�X�Ļ�ѧ��Ӧ����Ϊ___________________.
��3���÷�Ӧ�ڲ�ͬ�¶��µ�ƽ�ⳣ�������ʾ��
T/�� | 100 | 220 | 830 | 1000 | 1200 |
K | 45.00 | 32.00 | 1.00 | 0.60 | 0.38 |
��÷�Ӧ�Ħ�H__________0 (�>������<����=��)
��4��830��ʱ�����ݻ�Ϊ10L�ĺ����ܱ������г���5molX���塢7.8molY�����7.1mol Z���壬��ʱ��(��)_______��(��) (�>������<����=��)
��5����ͼ��ʾ��Ӧ���¶�Ϊ_________________��
���𰸡�X + Y ![]() 2 Z 0.04 mol/(L��s) < < 220��
2 Z 0.04 mol/(L��s) < < 220��
��������
��1�����ݻ�ѧ��Ӧ�и����ʵ����ʵ����ı仯���뻯ѧ������֮�ȳ�������д��ѧ����ʽ��
��2�����ݹ�ʽ��=![]() ���㻯ѧ��Ӧ���ʣ�
���㻯ѧ��Ӧ���ʣ�
��3���ɱ��������ݿ�֪���¶����ߣ�ƽ�ⳣ����С��������ƽ�������ƶ���������ƽ�������ȷ�Ӧ�����ƶ������淴ӦΪ���ȷ�Ӧ������ӦΪ���ȷ�Ӧ��
��4������˿̸÷�Ӧ��Ũ���̣�������¶��µ�ƽ�ⳣ�����бȽϣ��ݴ��жϷ�Ӧ���еķ������Ƚ����淴Ӧ���ʵĴ�С��
��5������ͼʾ����ƽ��ʱ�����ʵ�Ũ�ȣ�����ƽ�ⳣ�����ж��������¶ȡ�
��1����ͼ����Կ���X��Y�����ʵ�����С��Z�����ʵ������࣬��X��YΪ��Ӧ�ZΪ�������ѧ��Ӧ�и����ʵ����ʵ����ı仯���뻯ѧ������֮�ȳ����ȣ�����![]() n(X):
n(X):![]() n(Y):
n(Y):![]() n(Z)=(1.20mol0.40mol):(1.00mol0.20mol):1.60mol=1:1:2����Ӧ�Ļ�ѧ����ʽΪX+Y2Z��
n(Z)=(1.20mol0.40mol):(1.00mol0.20mol):1.60mol=1:1:2����Ӧ�Ļ�ѧ����ʽΪX+Y2Z��
�ʴ�Ϊ��X+Y2Z��
��2��0~10s�ڣ�X�Ļ�ѧ��Ӧ����Ϊ�ԣ�X��=��1.20mol-0.40mol����2L��10s=0.04 mol/(L��s)��
�ʴ�Ϊ��0.04 mol/(L��s)��
��3���ɱ��������ݿ�֪���¶����ߣ�ƽ�ⳣ����С��������ƽ�������ƶ���������ƽ�������ȷ�Ӧ�����ƶ������淴ӦΪ���ȷ�Ӧ������ӦΪ���ȷ�Ӧ����÷�Ӧ����H<0��
�ʴ�Ϊ��<��
��4��830��ʱ���÷�Ӧ��ƽ�ⳣ��Ϊ1.00���˿̸÷�Ӧ��Ũ����Ϊ![]() ����Ӧ�����淴Ӧ������У���(��)<��(��)��
����Ӧ�����淴Ӧ������У���(��)<��(��)��
�ʴ�Ϊ��<��
��5����ͼ��ʾ���ﵽƽ��ʱX��Y��Z�����ʵ����ֱ�Ϊ0.40mol��0.20mol��1.60mol�������ݻ�Ϊ2L��Ũ�ȷֱ�Ϊ0.20 mol/L��0.10 mol/L��0.80 mol/L����ƽ�ⳣ��Ϊ![]() �����¶�Ϊ220����
�����¶�Ϊ220����
�ʴ�Ϊ��220����


 ��ĩ���100�ִ��½����ȫ�Ծ�ϵ�д�
��ĩ���100�ִ��½����ȫ�Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ֻ��ƿ�зֱ����Ũ�Ⱦ�Ϊl molL-1 �������NH4Cl��Һ�����¶Ⱥ�pH ����������Һ��������ƿ��ͬʱ�����������������״����ͬ��þ����ʵ��������ͼ�����ڸ�ʵ�������˵������ȷ����
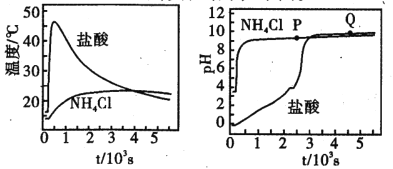
A.P����Һ��c(NH4+) + 2c(Mg2+) >c(Cl-)
B.��Ӧ���ҳ̶ȣ�NH4Cl >HCl
C.Q����Һ�Լ�������ΪMgCl2����ˮ��
D.1000s��þ��NH4Cl��Һ��Ӧֹͣ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H2O2��Ϊ��ɫ��������Ӧ���ڷ�ˮ��������ֽ�ͻ�ѧ�ϳɵ���ҵ��
��1����֪��H2(g)+![]() O2(g)=H2O(l) ��H1=��285.8kJ��mol-1
O2(g)=H2O(l) ��H1=��285.8kJ��mol-1
H2(g)+O2(g)=H2O2(l) ��H2=��135.8kJ��mol-1
��H2(g)��O2(g)�ķ�Ӧ�У�������ѧ�ϸ������IJ�����__��ԭ����__��
�ڳ����£�H2O2�ֽ���Ȼ�ѧ����ʽΪ__��
��2���ҹ���ѧ��ʹ��Ag9�Ŵ����������о�H2O2�ĺϳɡ�������Ļ�ܺͷ�Ӧ�ȣ������ʾ�����ü����ģ�ⷴӦ������ͼ��ʾ��TS��ʾ����̬����ʾ���������������֣���
Ag9�Ŵ�������H2O2�Ļ��Ea�ͷ�Ӧ��![]()
���� | ����̬ | Ea/kJ |
| |
A | Ag9 | TS1 | 74.1 | +68.7 |
B | H��Ag9 | TS2 | 108.7 | -27.2 |
C | H��Ag9��H+ O2 | TS3 | 78.4 | -75.4 |
D | HOO | TS4 | 124.7 | +31.3 |

��ͨ�����Ͳ���___������ĸ�������ݣ���ܣ������Խϴ������ߺϳɷ�Ӧ�����ʡ�
�ڷ�Ӧ������2��3���ѵĻ�ѧ��Ϊ___������ţ���
A.O2������� B.H2������ C.Ag9OOH������
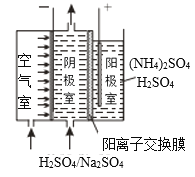
��3������������ͬ���ŵ����H2O2�������[(NH4)2S2O8]��ԭ����ͼ��ʾ�������Ϸŵ��������___�������ĵ缫��ӦʽΪ___��
��4�������£�H2O2�ֽ����ʷ���v=0.0625��c(H2O2)mg��L-1��s-1��c(H2O2)��ʱ��仯���±���
C(H2O2) (mg | 10000.0 | 8000.0 | 4000.0 | 2000.0 | 1000.0 |
�ֽ�ʱ��(s) | 0 | 7 | 23 | 39 | 55 |
�ٵ�c(H2O2)=8000.0mg��L-1ʱ��v=__mg��L-1��s-1��
�ڵ�c(H2O2)��Ϊ5000.0mg��L-1ʱ���ֽ�ʱ��Ϊ___s��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ѣ�DME������Ϊ��21���͵����ȼ�ϡ����ϳ���(��Ҫ�ɷ�ΪCO��CO2��H2)����Ҫ�Ļ���ԭ�ϣ������úϳ����ڴ���������ֱ���Ʊ�������(CH3OCH3)��
��֪���� CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ��H1=-49.0kJ��mol-1
CH3OH(g)+H2O(g) ��H1=-49.0kJ��mol-1
�� CO2(g)+H2(g)![]() CO(g)+H2O(g) ��H2=+41.1 kJ��mol-1
CO(g)+H2O(g) ��H2=+41.1 kJ��mol-1
�� 2CH3OH(g)![]() CH3OCH3(g)+H2O(g) ��H3=-24.5 kJ��mol-1
CH3OCH3(g)+H2O(g) ��H3=-24.5 kJ��mol-1
��1����ҵ����CO2��H2��һ�������·�Ӧֱ���Ʊ������ѣ�����ӦΪ��2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
��Ҫʹ�÷�Ӧ���ʺͲ��ʶ�����Ӧ�ò�ȡ�Ĵ�ʩ��__________________________________����
��һ�������£���������Ӧ�ﵽƽ��״̬�����ı䷴Ӧ��ijһ�����������б仯��˵��ƽ��һ��������Ӧ�����ƶ�����__________(����)��
a���淴Ӧ������������С b��H2��ת��������
c����Ӧ�������ٷֺ�����С d�������е�![]() ��С
��С
����ijѹǿ�£��Ʊ������ѵķ�Ӧ�ڲ�ͬ�¶ȡ���ͬͶ�ϱ�ʱCO2��ת������ͼ(a)��ʾ��T1�¶��£���6molCO2��12molH2����10L���ܱ������У� 5 min��Ӧ�ﵽƽ��״̬����05 min�ڵ�ƽ����Ӧ������(CH3OCH3)=__________��KA�� KB�� KC����֮��Ĵ�С��ϵΪ___________��
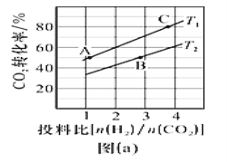

��2�����ʵ���������CO��H2ֱ���Ʊ������ѣ���һ����Ϊˮ������
�ٸ÷�Ӧ���Ȼ�ѧ����ʽ��_______________________________��
��CO��ת���ʡ������ѵIJ����뷴Ӧ�¶ȵĹ�ϵ��ͼ(b)��ʾ�������290��������¶ȣ�CH3OCH3�������ߵ͵�ԭ�������________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��ʾװ�òⶨ�к��ȵ�ʵ�鲽�����£�
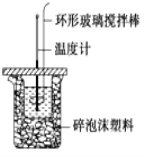
������Ͳ��ȡ50mL 0.50molL-1���ᵹ��С�ձ��У����������¶ȣ�Ȼ����¶ȼ��ϵ� ����ˮ��ϴ�ɾ���
������һ��Ͳ��ȡ50mL 0.55molL-1 NaOH��Һ������ͬһ�¶ȼƲ�����¶ȣ�
�۽�NaOH��Һ����С�ձ��У��跨ʹ֮��Ͼ��ȣ���û��Һ����¶ȡ��ش��������⣺
��1��ʵ����NaOH��Һ���Թ�����Ŀ����_________________________________________��
��2��ʹ������NaOH��Һ��Ͼ��ȵ���ȷ������_______������ţ���
A�����¶ȼ�С�Ľ��� B���ҿ�ӲֽƬ�ò���������
C����������ձ� D���������¶ȼ��ϵĻ��β����������������½���
��3��ʵ���и���60mL 0.50mol��L-1������50mL 0.55mol��L-1 NaOH��Һ���з�Ӧ��������ʵ����ȣ��ų�������______________(���� ƫ������ƫ�����������������ͬ)������õ��к��Ȧ�H ______________��
��4���������ʵ�����к��Ȧ�H = -55.6kJ/mol������֪��Ba2+(aq)+2OH-(aq)+ 2H++SO42- (aq)=BaSO4(s) +2H2O(l) ����H��-1584.2 kJ��mol-1��������BaSO4(s)�ķ�Ӧ����H��______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����C=C�����ʣ�ϩ����һ������������ˮ�����ӳɷ�Ӧ�����ɴ������ǻ���������������л���A-D�����ͼʾ��ת����ϵ������˵������ȷ����
![]()
A.D�ṹ��ʽΪCH3COOCH2CH3B.A��ʹ���Ը��������Һ��ɫ
C.B�����ᷢ����ȡ����ӦD.����B��ȡ��ˮ�еĵⵥ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ��ȡ9.00g��������ˮ���ⶨ���۵�ˮ��ٷ��ʣ���������£�

�Իش��������⣺
��1������������Լ�Ϊ��A_________��B_________��C_________��
��2������A��Һ��������B��Һ�Ƿ����_________����������_________��
��3��д������ˮ��ķ���ʽ_________��
��4��������1.44gש��ɫ����ʱ������ˮ������_________��[��֪��������Cu��OH��2��Ӧ�Ļ�ѧ����ʽΪ��CH2OH��CHOH��4CHO+2Cu��OH��2![]() CH2OH��CHOH��4COOH+Cu2O��+2H2O]��
CH2OH��CHOH��4COOH+Cu2O��+2H2O]��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ҵ��ķ�Ӧ�У�Ũ�����������
A.��ˮ����B.������C.������ˮ����D.��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��![]() �ǰ���٤��������ֵ������˵����ȷ����( )
�ǰ���٤��������ֵ������˵����ȷ����( )
A.23 g Na�������г��ȼ������![]() ��ת�Ƶ�����Ϊ2
��ת�Ƶ�����Ϊ2![]()
B.![]() ��NaOH��Һ�У�����
��NaOH��Һ�У�����![]() ������Ϊ0.01
������Ϊ0.01![]()
C.������Ϊ![]() ��
��![]() ���ӵ�����Ϊ1.6g
���ӵ�����Ϊ1.6g
D.��״���£�3.36 L��![]() �к�����ԭ�ӵ���ĿΪ0.45
�к�����ԭ�ӵ���ĿΪ0.45![]()
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com