
| A.容器内气体压强保持不变 |
| B.容器内各物质的浓度不随时间变化 |
| C.当υ(H2,正)=0.3mol·L-1·min-1,υ(NH3,逆)=0.2mol·L-1·min-1时 |
| D.1个N≡N键断裂的同时,有3个H-H键形成 |
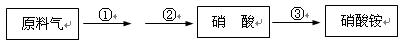
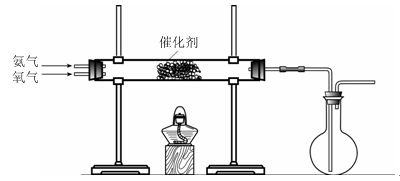
 4HNO3,原料气为氨气和空气的混合物。
4HNO3,原料气为氨气和空气的混合物。科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
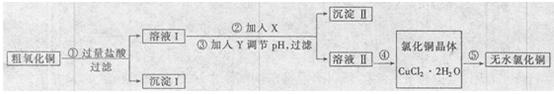
| | 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH |
| Fe3+ | 1.9 | 3.2 |
| Fe2+| | 7.0 | 9.0 |
| Cu2+ | 4.7 | 6.7 |
| 提供的试剂:a. NaOH b. H2O2 c. Na2CO3 d. CuO | ||
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
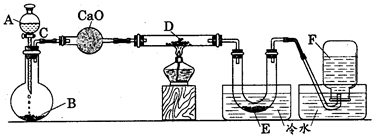 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.复盐的溶解度一般比组成它的每一种盐都小 |
| B.合金的熔点一般比组成它的每一种金属都高 |
| C.用NaOH溶液和铝盐反应得不到Al(OH)3沉淀,因此一般用氨水与铝盐反应制备 Al(OH)3 |
| D.萃取剂选择的标准之一是不能与被萃取的物质反应,并且密度要比原溶剂大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
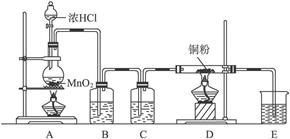
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
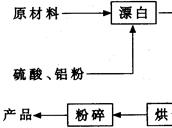
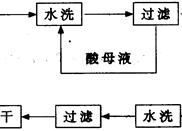
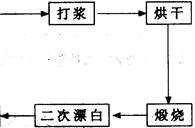
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
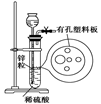
| A.①③⑤ | B.①②③ | C.④⑤⑥ | D.①②③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com