
【题目】下列有关组成生物体元素和化合物的叙述,正确的是
A. C是构成细胞的最基本元素,因为碳链是构成生物大分子的骨架
B. 细胞中的微量元素因含量极少而不如大量元素重要
C. 细胞中的脱氧核苷酸和脂肪都不含有氮元素
D. 蔗糖和麦芽糖彻底水解后,得到的产物是相同的
 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案科目:高中化学 来源: 题型:
【题目】氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
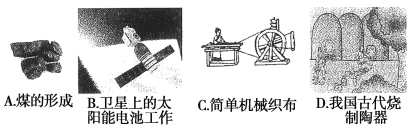
(1)下列生产、生活中的事例中没有发生氧化还原反应的是( )
(2)水是人体的重要组成部分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原反应的关系”也可用下图表达。
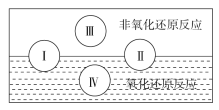
试写出有水参加的符合反应类型Ⅳ的一个离子反应方程式: ,其中水为________剂。
(3)氯化铵常用于焊接。如在焊接铜器时用过量的浓氯化铵溶液除去铜器表面的氧化铜以便焊接,其反应为:____CuO+____NH4Cl![]() ____Cu+____CuCl2+____N2↑+____H2O。
____Cu+____CuCl2+____N2↑+____H2O。
①配平此氧化还原反应方程式。(配平时系数为“1”必须写出)
②该反应中,被氧化的元素是________(填元素名称),氧化剂是____________(填化学式)。
③往反应后的热溶液中加入过量澄清的石灰水,发现有气泡产生和蓝色沉淀生成,写出两个相应现象的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水晒盐后所得的苦卤中含有较高浓度的MgCl2、KCl以及金属溴化物。以下是苦卤化学分离的过程。
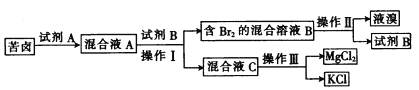
回答下列问题:
(1) 若试剂A是一种有色气体单质,则A是__________ (填化学式);写出该反应的离子方程式:___________。
(2) “操作II”是_______ (填“蒸发”“ 蒸馏”“ 分液”或“重结晶”,下同),“操作III”是________。
(3) 试剂B可能是下列物质中的________ (填字母)。
A.饱和NaCl溶液 B.CCl4 c.NaOH D.乙醇
实验室中也可用苯代替试剂B,但工业生产中,通常不使用苯,理由是____________________(任写两点)。
(4) MgCl2中可能含有NaCl杂质,检验杂质存在的方法是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,H2(g)+CO2(g)![]() H2O(g)+CO(g)的平衡常数K=
H2O(g)+CO(g)的平衡常数K=![]() 。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示。下列判断不正确的是( )
。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示。下列判断不正确的是( )
起始浓度 | 甲 | 乙 | 丙 |
c(H2)/mol/L | 0.010 | 0.020 | 0.020 |
c(CO2)/mol/L | 0.010 | 0.010 | 0.020 |
A. 平衡时,乙中CO2的转化率大于60%
B. 平衡时,甲中和丙中H2的转化率均是60%
C. 平衡时,丙中c(CO2)是甲中的2倍,是0.012mol/L
D. 反应开始时,丙中的反应速率最快,甲中的反应速率最慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体内的微量元素的含量甚微,但是对人体的健康起着重要作用。下列全部是微量元素的是
A. I、K、O、S B. Fe、Zn、Cu、B、Mo
C. N、H、O、P、C D. Fe、Ca、Cu、Mg、C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在熔融碳酸盐燃料电池中的应用以熔融Li2CO3和K2CO3为电解质,天然气经内重整催化作用提供反应气的燃料电池示意图如右:

(1)外电路电子流动方向:由 流向 (填字母A 或B)。
(2)空气极发生反应的离子方程式是 。
(3)以此燃料电池为电源电解精炼铜,当电路有0.6 mol e 转移,有 g 精铜析出。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关性质的比较,不能用元素周期律解释的是
A. 碱性:KOH>NaOH B. 金属性:Na>Mg
C. 稳定性:HF>CH4 D. 酸性:HF<HCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com