
| A. | 在船外壳镶嵌锌块保护船身,锌为原电池的负极 | |
| B. | MgO的熔点高于NaCl,是因为MgO的晶格能大于NaCl | |
| C. | 1molFeCl3完全水解将产生6.02×1023个胶体粒子 | |
| D. | 水的离子积常数Ksp随着温度的升高而增大,说明水的电离是吸热过程 |
分析 A.原电池的正极金属易被保护,不易腐蚀;
B.均为离子晶体,晶格能大的熔点高,晶格能与离子半径与离子电荷有关;
C.Fe(OH)3胶体粒子是由Fe(OH)3“分子”聚合成的较大颗粒;
D.水的离子积随温度升高增大,说明氢离子和氢氧根离子浓度增大,所以水的电离是吸热过程.
解答 解:A.海轮外壳镶嵌锌块,锌为原电池的负极,此时铁作为原电池的正极金属而被保护,不易腐蚀,是采用了牺牲阳极的阴极保护法,故A正确;
B.决定晶格能的因素为:离子电荷、离子半径、离子的电子层构型,MgO所带电荷多,MgO的熔点高于NaCl,故B正确;
C.Fe(OH)3胶体粒子是由Fe(OH)3“分子”聚合成的较大颗粒,含1molFe3+的FeCl3完全水解,产生Fe(OH)3胶体粒子小于6.02×1023,故C错误;
D.水的离子积随温度升高增大,说明氢离子和氢氧根离子浓度增大,促进水的电离,所以水的电离是吸热过程,故D正确.
故选C.
点评 本题考查金属腐蚀、晶格能、胶体和离子积,题目难度不大,做题时注意物质的组成、结构、性质以及存在的状态和条件等问题.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题

| A. | 当闭合开关S1,断开开关S2,右石墨棒发生的电极反应为:2H2O-4e-=4H++O2↑ | |
| B. | 石墨棒使用前在高温火焰上灼烧至红热,迅速浸入冷水,可以使表面粗糙多空,吸附更多的气体 | |
| C. | 先闭合开关S1,一段时间后断开,再闭合S2,可以观察到发光二级管发光 | |
| D. | 断开S2,闭合S1,更换电解质,可以用来模拟工业制氯气,粗铜冶炼制精铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L一氯甲烷和二氯甲烷的混合物中所含的氯原子数介于NA至2NA之间 | |
| B. | 0.1 mol Cu与足量热的浓硫酸反应生成SO2的体积约为22.4 L | |
| C. | 0.2 mol•L-1 Na2S溶液中含有的S2-数目小于0.2NA | |
| D. | 在反应Zn+2HNO3+NH4NO3═N2↑+3H2O+Zn(NO3)2中每溶解1 mol Zn,转移的电子数大于2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 电解质 | H2C2O4 | CH3COOH | HCN | H2CO3 |
| 电离常数(mol•L-1) | K1=5.6×10-2 K2=5.4×10-3 | K1=1.7×10-5 | K2=6.2×10-10 | K1=4.2×10-7 K2=5.6×10-11 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1CH3COONa溶液与0.1mol•L-1HCl溶液等体积混合:c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-) | |
| B. | 某温度下,KSP(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12;将0.001 mol•L-1的AgNO3溶液滴入0.001 mol•L-1的KCl和0.001 mol•L-1的K2CrO4溶液,则先产生Ag2CrO4沉淀 | |
| C. | 0.1 mol•L-1Na2CO3溶液与0.1 mol•L-1NaHCO3溶液等体积混合:2c(Na+)=3[c(CO32-)+c(HCO3-)+c(H2CO3)] | |
| D. | 在0.1 mol•L-1氨水中滴加0.1 mol•L-1盐酸,刚好完全中和时pH=a,则由水电离产生的c(H+)=10-amol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 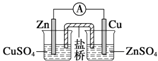 装置:构成锌-铜原电池 | |
| B. | 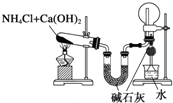 装置:实验室制氨气并收集干燥的氨气 | |
| C. | 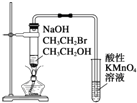 装置:验证溴乙烷发生消去反应生成烯烃 | |
| D. | 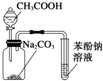 装置:由实验现象推知酸性强弱顺序为CH3COOH>H2CO3>C6H5OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数:W>M>X>Y>Z | B. | 原子半径:Z>W>M>Y>X | ||
| C. | 离子半径:W2+>Z+>M->Y2- | D. | 最简单氢化物的热稳定性:M>Y>X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O为直线型分子 | |
| B. | 反应中每生成1molS转移了2mol电子 | |
| C. | NaHS中含离子键和非极性键 | |
| D. | 琉单质(S8)为原子晶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com