
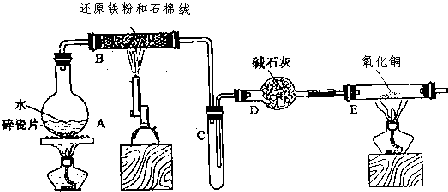
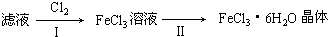
| ||
| ||
 Fe(OH)3+3H+,所以应在酸溶液中加热浓缩,主要是抑制三价铁的水解,故保持盐酸过量,
Fe(OH)3+3H+,所以应在酸溶液中加热浓缩,主要是抑制三价铁的水解,故保持盐酸过量, Fe(OH)3+3H+,过量盐酸抑制FeCl3水解.
Fe(OH)3+3H+,过量盐酸抑制FeCl3水解.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
| 探究内容 | 实验方案 | 实验现象 |
| 探究 Fe 2+ 具有还原性 | ||
| 探究 Fe 2+ 具有氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
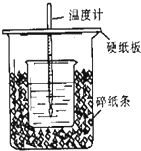 用50mL0.5mol/L的盐酸与50mL0.55mol/L的氢氧化钠在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.5mol/L的盐酸与50mL0.55mol/L的氢氧化钠在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该气体一定是纯净物 |
| B、该气体一定是CO、CO2的混合物 |
| C、该气体中所含的物质最多只有2种 |
| D、该气体的组成情况可能有3种组合 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 利用如图所示装置制备氧气并进行相关实验探究.
利用如图所示装置制备氧气并进行相关实验探究.查看答案和解析>>
科目:高中化学 来源: 题型:
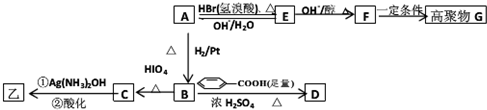
| △ |

查看答案和解析>>
科目:高中化学 来源: 题型:
 已知短周期主族元素A、B、C、D、E的原子序数依次增大,A、C、D原子的最外层电子数之和为12,C、D、E位于同一周期,B、D同主族.D原子的最外层电子数既是A原子内层电子数的3倍又是C原子最外层电子数的3倍.请回答下列问题:
已知短周期主族元素A、B、C、D、E的原子序数依次增大,A、C、D原子的最外层电子数之和为12,C、D、E位于同一周期,B、D同主族.D原子的最外层电子数既是A原子内层电子数的3倍又是C原子最外层电子数的3倍.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、新制氯水与碳酸氢钠不反应 |
| B、25℃时,0.1mol/L的醋酸溶液与0.01mol/L的醋酸溶液中,Ka前者小于后者 |
| C、25℃时,等物质的量浓度的碳酸钠溶液、醋酸钠溶液、次氯酸钠溶液的pHpH(Na2CO3)>pH(NaClO)>pH(CH3COONa) |
| D、25℃时,PH=9的NaHCO3溶液中:C(HCO3-)>C(CO32-)>C(H2CO3) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com