
【题目】下列物质中既能导电,又属于强电解质的一组物质是( )
A.石墨、醋酸溶液、食盐晶体
B.熔融状态的KOH、熔融状态的NaCl
C.稀H2SO4、NaOH溶液、纯HNO3
D.液氨、石灰水、水银
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
【题目】下列有关叙述错误的是( )
A.酸性:HClO4>HBrO4B.稳定性:HF>HClC.碱性:KOH>NaOH>LiOH D.原子半径:S>Si
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】要证明某溶液中含Fe2+而不含有Fe3+,进行如下实验操作时最佳顺序为( )
①加入足量氯水 ②观察到无现象 ③加入少量KSCN溶液
A.①③②B.③①②C.③②①D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】太阳能电池板面对太阳时,一部分电能直接供给“天宫一号”,一部分电能则储存在电池里,供背离太阳时使用。“天宫一号”使用的是镍氢电池,电解质溶液显碱性。其反应方程式为: LaNi5+Ni(OH)2![]() LaNi5H+NiOOH。下列有关说法不正确的是
LaNi5H+NiOOH。下列有关说法不正确的是
A.放电时镍被还原 B.放电时负极LaNi5H+OH——e—=LaNi5+H2O
C.充电时OH—向阴极移动 D.充电时每消耗lmol Ni(OH)2转移lmol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质与其用途的对应关系正确的是( )
选项 | 物质 | 用途 |
A | 硅单质 | 制作光导纤维 |
B | 烧碱 | 治疗胃酸过多 |
C | 铁罐车 | 常温下用于运输浓硝酸 |
D | 液氨 | 用作消毒剂 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)科学家可以通过__________法发现太阳存在有大量的铁元素,写出基态Fe原子的价电子排布图__________________。从结构上分析Fe3+比Fe2+稳定的原因:________________________。
(2)SCN-常用来检测Fe3+的存在,SCN-中心原子的杂化方式为_________,三种元素电负性由大到小的顺序为__________________。
(3)砷化镓以第三代半导体著称,熔点为1230℃,具有空间网状结构。已知氮化硼与砷化镓属于同种晶体类型。则两种晶体熔点较高的是_________(填化学式),其理由是________________________。
(4)C60分子又名足球烯,它是由60个碳原子组成的球状分子,右图为C60结构图。一个C60分子中六元环的数目为____________,在C60晶胞中C60分子的配位数为___________。已知C60分子的球体 半径为a nm,求C60晶体的ρ=_________g/cm3。(用NA表示阿伏加德罗常数,写出表达式)
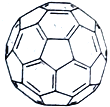
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 所有自发进行的化学反应都是放热反应
B. 同一物质固、液、气三种状态的熵值相同
C. △H < 0、△S > 0的反应可自发进行
D. 在其他条件不变的情况下,使用催化剂可以改变化学反应进行的方向
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家开发出一种“洁净煤技术”,通过向地下煤层“气化炉”中交替鼓入空气和水蒸气的方法,连续产出高热值的煤炭气,其主要成分是CO和H2。“气化炉”中主要反应有:C(s)+ +H2O (g) =CO(g)+H2(g) △H= +131.3 kJmol-1
CO(g)+H2O(g) =CO2(g)+H2(g) △H= — 41.2kJmol-1
(1)气化炉中CO2与C反应转化为CO,该反应的热化学方程式是 __________________________________。
(2)用煤炭气合成甲醇的反应为CO(g)+2H2(g) ![]() CH3OH(g)。在密闭容器中,将CO和H2按物质的量1:2混合反应,CO的平衡转化率与温度、压强的关系如右图所示:
CH3OH(g)。在密闭容器中,将CO和H2按物质的量1:2混合反应,CO的平衡转化率与温度、压强的关系如右图所示:
①生成甲醇的反应为_______(填“放热”或“吸热”)。
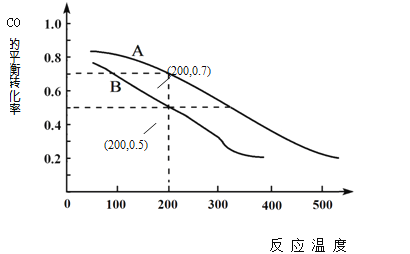
②图中两条曲线分别表示压强为0.1MPa和5.0MPa下CO转化率随温度的变化,其中代表压强是5.0MPa的曲线是____________(填“A”或“B”)。
③在不改变反应物用量的前提下,为提高CO转化率可采取的措施有 _______________________ 。
④压强为0.1MPa、温度为200℃时,平衡混合气中甲醇的物质的量分数是 _______________。
(3)某新型电池以熔融碳酸盐作电解质,在650℃下工作,负极通入煤炭气,正极通入空气与CO2的混合气.电池的正极反应式为O2+2CO2+4e-=2CO32—,负极反应式为 ___________________和_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铀是原子反应堆的原料,常见铀的化合物有UF4、UO2、及(NH4)4[UO2(CO3)3]等,回答下列问题:
(1)基态氟原子的价电子排布图为________________;用Mg或Ca还原UF4可得金属铀,其氧化产物MgF2的熔点高于CaF2,原因是_______________________________;
(2)已知:2UO2+5NH4HF2![]() 2UF4·2NH4F+3NH3↑+4H2O↑
2UF4·2NH4F+3NH3↑+4H2O↑
①NH4HF2中存在的微粒间的作用力是__________(填选项字母)。
A.离子键 B.配位键 C.共价键 D.范德华力
②该反应中非金属元素的第一电离能由大到小的顺序是__________(填元素符号)。
(3)已知:3(NH4)4[UO2(CO3)3] ![]() 3UO2+10NH3↑+9CO2↑+ N2↑+ 9H2O↑
3UO2+10NH3↑+9CO2↑+ N2↑+ 9H2O↑
①分解产物中属于非极性分子的是_________(填选项字母)。
A.NH3 B.CO2 C.N2 D.H2O
②反应物中的CO32-的空间构型为_____________。分子中的大![]() 键可用符号
键可用符号![]() 表示,其中m代表参与形成大
表示,其中m代表参与形成大![]() 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大![]() 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大![]() 键可表示为
键可表示为![]() ),则CO32-中的大
),则CO32-中的大![]() 键应表示为______________。
键应表示为______________。
③HN3(氢叠氮酸)常用于引爆剂,其分子的结构式可表示为:![]() 。则左边氮原子和中间氮原子的杂化方式分别为______________、_______________。
。则左边氮原子和中间氮原子的杂化方式分别为______________、_______________。
(4)UO2的晶胞结构如图所示:
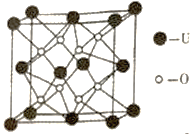
①晶胞中铀原子位于面心和顶点,氧原子填充在铀原子堆积形成的空隙中。则氧原子填充在铀原子形成的___________空隙中。(填“立方体”、“四面体”、“八面体”)
②若两个氧原子间的最短距离为a nm,则UO2晶体的密度为___________g·cm-3(列出计算式即可,设NA表示阿伏加德罗常数的值)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com